Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 câu 2 giống nhau nên tui làm câu 1 thôi nha
\(N_2+3H_2\rightarrow2NH_3\)
\(H=20\%\Rightarrow n_{N_2}=2.0,2=0,4\left(mol\right);n_{H_2}=6.0,2=1,2\left(mol\right)\)
=> Tính theo N2
\(\Rightarrow m_{NH_3}=2.n_{N_2}.17=13,6\left(g\right)\)
3/ \(N_2+3H_2\rightarrow2NH_3\)
\(V--3V--2V\)
Thể tích còn lại sau phản ứng bao gồm N2 dư, H2 dư và NH3
\(\Rightarrow V_{N_2}-V+V_{H_2}-3V+2V=16,4\Rightarrow V=0,8\left(l\right)\) \(\Rightarrow V_{NH_3}=2.0,8=1,6\left(l\right)\)
\(\Rightarrow H=\frac{V}{V_{N_2}}=\frac{0,8}{4}=20\%\)
cho 1,86g hỗn hợp kim loại Mg và Al vào dung dịch HNO3 loãng , dư thì thu được 560ml khí N2O (đktc)
a. Viết phương trình phản ứng xảy ra
b. Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu

`1>{1,2}/3->H` tính theo `H_2.`
Tại TTCB: `[H_2]=3/{2}[NH_3]=0,3M`
`->C_{H_2\ pu}=1,2-0,3=0,9M`
`->H={0,9}/{1,2}.100\%=75\%`
Không có đáp án đúng.

Đáp án D
Nồng độ ban đầu của N2 và H2 lần lượt là: x, y mol/l
![]()
Ban đầu x y mol/l
Phản ứng 1 3 ← 2mol/l
Sau pứ x-1 y-32mol/l
Ta có: [N2]= 2,5 mol/l= x-1 nên x= 3,5M
[H2]= 1,5 mol/l= y-3 nên y=4,5M

- Đáp án A
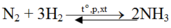
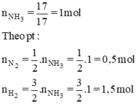
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).

N2+3H2\(\rightarrow\)2NH3
Kcb=\(\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0,6^2}{0,02.2^3}=2,25\)
Đáp án B

`N_2(g)+3H_2` $\leftrightharpoons$ `2NH_3(g)`
`K_C={[NH_3]^2}/{[N_2].[H_2]^3}={0,3^2}/{0,5.0,1^3}=180`
Không đáp án đúng.

$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$
Ở TTCB: \(K_C=\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{\left[NH_3\right]^2}{0,00402.0,1200^3}=0,1050\)
\(\Rightarrow\left[NH_3\right]\approx8,54.10^{-4}\left(M\right)\)