K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

26 tháng 12 2019
Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
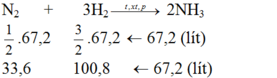
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
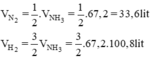
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
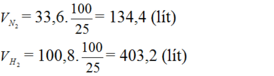

H
31 tháng 7 2021
$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$
- Đáp án A
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).