Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hiệu độ âm cực càng lớn thì độ phân cực càng mạnh.
---
Áp dụng bài tập:
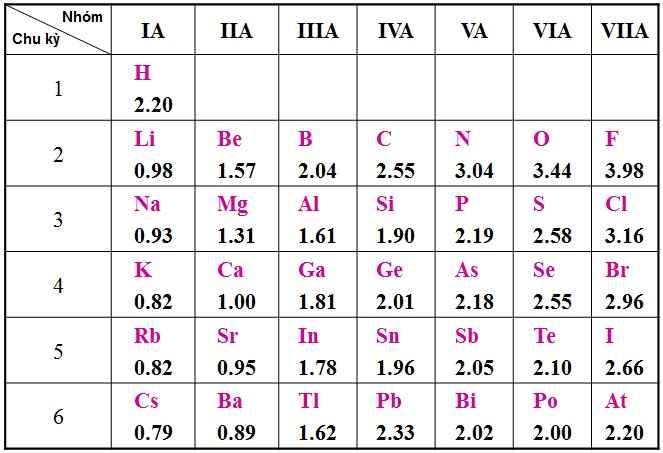
Hiệu độ âm điện của NH3: 3,04 - 2,2= 0,84
Hiệu độ âm điện của H2S: 2,58 - 2,2= 0,38
Hiệu độ âm điện của H2O: 3,44 - 2,2= 1,24
Hiệu độ âm điện của H2Te: 2,2 - 2,1= 0,1
Hiệu độ âm điện của CsCl: 3,16 - 0,79= 2,37
Hiệu độ âm điện của CaS: 2,58 - 1= 1,58
Hiệu độ âm điện của BaF2: 2,58 - 0,89= 1,69
Ta thấy: 2,37 > 1,69 > 1,58 > 1,24 > 0,84 > 0,38 > 0,1
=> Thứ tự độ phân cực: CsCl > BaF2 > CaS > H2O > NH3 > H2S > H2Te

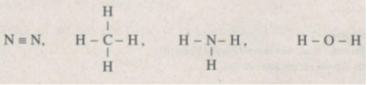
Các liên kết trong phân tử N 2 là các liên kết cộng hoá trị điển hình, không phân cực vì đó là những liên kết giữa hai nguyên tử giống nhau (hiệu độ im điện bằng không).
Các liên kết trong các phân tử còn lại là các liên kết giữa các nguyên tử trong cùng một chu kì (C, N, O) và nguyên tử H (độ âm điện bằng 2,20). ri trong cùng một chu kì, độ âm điện tăng dần từ trái sang phải nên so với H, hiệu độ âm điện cũng tăng theo, do đó các liên kết trong phân tử H 2 O là các liên kết phân cực mạnh nhất.

Chọn A
Hiệu độ âm điện của C và H là 0,35. Vậy phân tử CH4 có liên kết cộng hóa trị không phân cực.

-CHT k phân cực : H2S
-CHT phân cực : H2O, CaS ,NH3
- Ion:CsCl , BeFe2