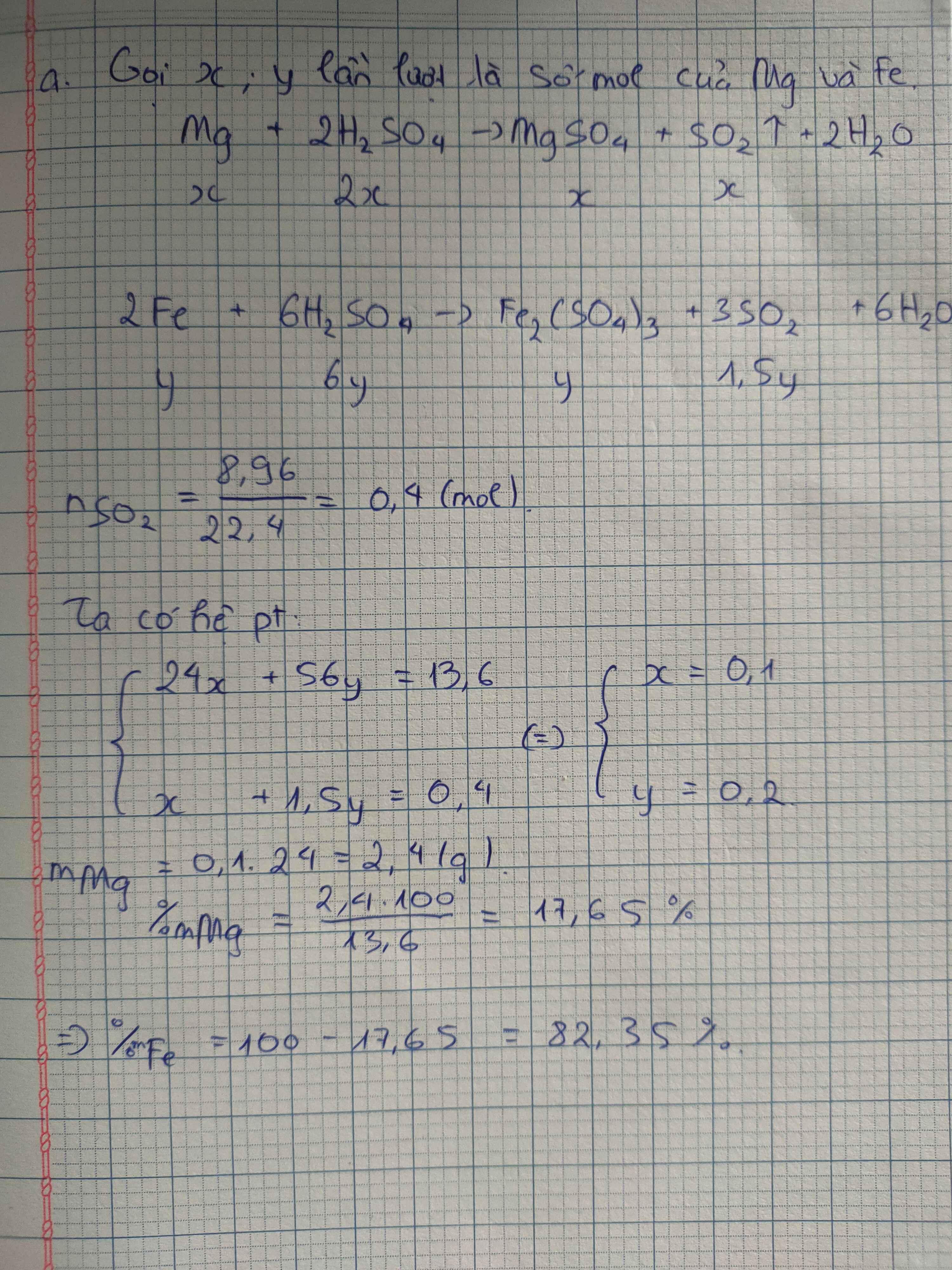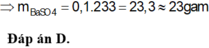Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+) Gọi số \(\text{mol etan}\) là \(\text{x}\) và số mol propylen là \(\text{2x}\)
\(\text{Br2}\) phản ứng với \(\text{etan}\) và \(\text{propylen}\) theo tỉ lệ \(\text{1 : 1}\)
\(\Rightarrow\) số mol \(\text{Br2}\) cần để phản ứng hoàn toàn với \(\text{etan}\) và \(\text{propylen}\) là \(\text{x + 2x = 3x}\)
+) Theo quy tắc cân bằng khối lượng, khối lượng \(\text{Br2}\) tăng là \(\text{8,4g}\) , Vì vậy, ta có
\(\text{3x . (molar mass Br2) = 8,4g}\)
\(\text{3x . (159.8 g/mol) = 8,4g}\)
\(\text{479 . 4x = 8,4g}\)
\(\text{x = 8,4g / 479.4}\)
\(\Rightarrow\) \(\text{x ≈ 0,0175 mol}\)
\(\Rightarrow\) số \(\text{mol etan}\) là \(\text{0,0175 mol}\) và số \(\text{mol propylen}\) là \(\text{2 . 0,0175 = 0,035 mol}\)
+) Với \(\text{n}\) là số \(\text{mol}\) và \(\text{Vm}\) là thể tích \(\text{mol}\) của khí ở điều kiện tiêu chuẩn, Với \(\text{etan}\) và \(\text{propylen}\) \(\Rightarrow\) \(\text{Vm ≈ 22,4 L/mol}\)
\(\text{Vetan = 0,0175 mol . 22,4 }\)\(\Rightarrow\) \(\text{L/mol ≈ 0,392 L}\)
\(\text{Vpropylen = 0,035 mol . 22,4}\) \(\Rightarrow\) \(\text{L/mol ≈ 0,784 L}\)
Vậy thể tích hỗn hợp ban đầu là \(\text{0,392 + 0,784 = 1,176 L}\)
____________________________________________________________
Để tính thể tích khi hỗn hợp đi qua dd, ta cần biết phản ứng hoàn toàn và dd nhạt màu một phần khác phản ứng. Điều này cho thấy \(\text{Br2}\) đã phản ứng với \(\text{etan}\) và propylen, và không còn \(\text{Br2}\) tồn tại trong \(\text{dd}\)
Vậy thể tích khi hỗn hợp đi qua \(\text{dd}\) là \(\text{0 L}\)

a)
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} =\dfrac{9,75}{65} = 0,15 > n_S = \dfrac{3,84}{32} = 0,12$ nên Zn dư
$n_{ZnS} = n_S = 0,12(mol)$
$m_{ZnS} = 0,12.97 = 11,64(gam)$
$n_{Zn\ dư} = 0,15 - 0,12 = 0,03(mol)$
$m_{Zn\ dư} = 0,03.65 = 1,95(gam)$
b)
$Zn + 2HCl \to ZnCl_2 + H_2$
$ZnS + 2HCl \to ZnCl_2 + H_2S$
$n_{khí} = n_{H_2} + n_{H_2S} = n_{Zn\ dư} + n_{ZnS} = 0,15(mol)$
$V = 0,15.22,4 = 3,36(lít)$
\(n_{Zn}=\dfrac{9.75}{65}=0.15\left(mol\right)\)
\(n_S=\dfrac{3.84}{32}=0.12\left(mol\right)\)
\(Zn+S\underrightarrow{^{^{t^0}}}ZnS\)
Lập tỉ lệ :
\(\dfrac{0.15}{1}>\dfrac{0.12}{1}\Rightarrow Zndư\)
\(a.\)
\(m_X=m_{ZnS}+m_{Zn\left(dư\right)}=0.12\cdot97+\left(0.15-0.12\right)\cdot65=13.59\left(g\right)\)
\(b.\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.03..................................0.03\)
\(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
\(0.12.................................0.12\)
\(V_{khí}=0.03\cdot22.4+0.12\cdot22.4=3.36\left(l\right)\)