Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
(a) HCl + NaAlO2 +H2O → NaCl + Al(OH)3
(a)Al(OH)3 + 3HCl → AlCl3 + 3H2O
→ chỉ thu được 1 muối
(b) 2NaOH + Al2O3 → 2NaAlO2 +H2O → có 1 muối
(c) CO2 + Ba(OH)2 → Ba(HCO3)2 → 1 muối
(d) Fe + Fe2(SO4)3 → 3 FeSO4 → có 2 muối FeSO4 và Fe2(SO4)3
(e) 2KHSO4 + 2NaHCO3 → K2SO4 + Na2SO4 + 2H2O + 2 CO2
→ có 2 muối
(g) Cho Mg dư vào dung dịch HNO3 (phản ứng không thu được chất khí )
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3H2O
Sau khi các phản ứng xảy ra hoàn toàn thì số thí nghiệm thu được dung dịch chứa hai muối là 3
Đáp án A

(a) HCl + NaAlO2 +H2O → NaCl + Al(OH)3
(a)Al(OH)3 + 3HCl → AlCl3 + 3H2O
→ chỉ thu được 1 muối
(b) 2NaOH + Al2O3 → 2NaAlO2 +H2O → có 1 muối
(c) CO2 + Ba(OH)2 → Ba(HCO3)2 → 1 muối
(d) Fe + Fe2(SO4)3 → 3 FeSO4 → có 2 muối FeSO4 và Fe2(SO4)3
(e) 2KHSO4 + 2NaHCO3 → K2SO4 + Na2SO4 + 2H2O + 2 CO2
→ có 2 muối
(g) Cho Mg dư vào dung dịch HNO3 ( phản ứng không thu được chất khí )
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3H2O
Sau khi các phản ứng xảy ra hoàn toàn thì số thí nghiệm thu được dung dịch chứa hai muối là 3
Đáp án A

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
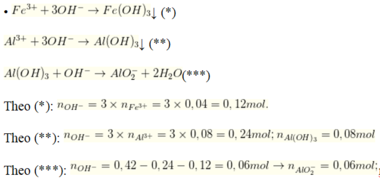
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

Những pt ion này bạn nên nhớ khi làm dạng toán HNO3.
\(3Cu+8H^++2NO_3^-\rightarrow3Cu^{2+}+2NO+4H_2O\)
0,3 \(\rightarrow\)0,8\(\rightarrow\) 0,2 \(\rightarrow\) 0,3\(\rightarrow\) 0,2
\(3Fe^{2+}+4H^++NO^-_3\rightarrow3Fe^{3+}+NO+2H_2O\)
0,6 \(\rightarrow\) 0,8 \(\rightarrow\) 0,2 \(\rightarrow\) 0,6 \(\rightarrow\) 0,2
\(\underrightarrow{BTe:}\) \(3n_{NO}=2n_{Fe}+2n_{Cu}\rightarrow n_{NO}=0,4\Rightarrow V_{NO}=8,96l\)

Đáp án B
Phương pháp:
Bảo toàn electron
Bảo toàn điện tích
Bảo toàn nguyên tố Fe, O, H
Hướng dẫn giải:
Phần kết tủa có nAgCl= 0,3 => nAg = 0,009
Bảo toàn electron: nFe2+ = nAg + 3nNO = 0,036
nNO = 0,009 => nH+ dư = 4nNO = 0,036
Đặt a, b, c là số mol Fe, Fe3O4, Fe(NO3)2 trong X
=> mX = 56a + 232b + 180c = 7,488 (1 )
Dung dịch Y còn H+ dư và Fe2+ nên NO3- đã hết.
Vậy Y chứa Fe2+ (0,036), H+ (0,036), Cl- (0,3)
Bảo toàn điện tích => nFe3+ = 0,064
Bảo toàn Fe => a + 3b + c = 0,064 + 0,036 (2)
Bảo toàn H => nH2O = 0,144
Bảo toàn O:
4nFe3O4 + 6nFe(NO3)2 + 3nHNO3 = nZ + nH2O
=> 4b + 6c + 0,024 . 3 = 0,032 + 0,144 (3)
Giải hệ (1)(2)(3): a = 0,05 b = 0,014 c = 0,008
=> %Fe = 37,4%

Chọn đáp án C.
Phương trình điện phân:
Catot: Fe3+ + e → Fe2+
Cu2+ + 2e → Cu
Fe2+ + 2e → Fe
Anot: 2H2O → 4H+ + O2 + 4e

![]()

Theo định luật bảo toàn điện tích: 0,02.3+ 0,03.2=x + 2y
mmuối= 0,02.27+ 0,03.56 + 35,5.x+ 96.y=7,23
Suy ra x=0,06; y=0,03
Ta có: 2 cation: 0,02 mol Al3+, 0,03 mol Fe2+ và 2 anion: 0,06 mol Cl-, 0,03 mol SO42-
Suy ra 2 muối là FeCl2 và Al2(SO4)3

Chọn đáp án B