Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Photpho cháy trong không khí lấy dư theo phản ứng :
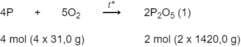
P 2 O 5 tác dụng với tạo thành H 3 P O 4 theo phản ứng :
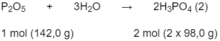
Theo phản ứng (1): 4 x 31,0 g P tạo ra 2 x 142,0 g P 2 O 5
a g P tạo ra 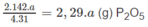
Theo các phản ứng (1) và (2) :
4 x 31,0 (g) P tạo ra 4 x 98,0 (g) H 3 P O 4
a (g) P tạo ra 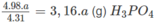
Khối lượng H 3 P O 4 có trong 500,0 ml dung dịch 85,00% :
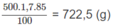
Khối lượng H 3 P O 4 sau khi đã hoà tan P 2 O 5 : 722,5 g + 3,16 x a g.
Khối lượng của dung dịch H 3 P O 4 sau khi đã hoà tan P 2 O 5 :
500,0 x 1,7 g + 2,29 x a g = 850,0 g + 2,29 x a g
Ta có phương trình về nồng độ phần trăm của dung dịch H 3 P O 4 :
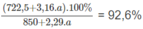
Giải phương trình được a = 62,16 g photpho.

Câu 1:
Ta có: \(n_{H_3PO_4}=0,15.1=0,15\left(mol\right)\)
\(n_{NaOH}=0,225.1=0,225\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{H_3PO_4}}=\dfrac{0,225}{0,15}=1,5\)
⇒ Pư tạo muối NaH2PO4 và Na2HPO4.
a, Giả sử: \(\left\{{}\begin{matrix}n_{NaH_2PO_4}=x\left(mol\right)\\n_{Na_2HPO_4}=y\left(mol\right)\end{matrix}\right.\)
BTNT Na, có: x + 2y = 0,225 (1)
BTNT P, có: x + y = 0,15 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,075\left(mol\right)\\y=0,075\left(mol\right)\end{matrix}\right.\)
⇒ mNaH2PO4 = 0,075.120 = 9 (g)
mNa2HPO4 = 0,075.142 = 10,65 (g)
b, \(C_{M_{NaH_2PO_4}}=C_{M_{Na_2HPO_4}}=\dfrac{0,075}{0,375}=0,2M\)
Câu 2:
Ta có: \(n_{H_3PO_4}=0,15\left(mol\right)\)
\(n_{KOH}=0,35\left(mol\right)\)
\(\Rightarrow\dfrac{n_{KOH}}{n_{H_3PO_4}}=2,333\)
Vậy: Pư tạo muối Na2HPO4 và Na3PO4.
a, Giả sử: \(\left\{{}\begin{matrix}n_{Na_2HPO_4}=x\left(mol\right)\\n_{Na_3PO_4}=y\left(mol\right)\end{matrix}\right.\)
BTNT Na, có: 2x + 3y = 0,35 (1)
BTNT P, có: x + y = 0,15 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Na_2HPO_4}=0,1.142=14,2\left(g\right)\)
\(m_{Na_3PO_4}=0,05.164=8,2\left(g\right)\)
b, Ta có: \(\left\{{}\begin{matrix}C_{M_{Na_2HPO_4}}=\dfrac{0,1}{0,5}=0,2M\\C_{M_{Na_3PO_4}}=\dfrac{0,05}{0,5}=0,1M\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án C
nP2O5=1 mol
nH3PO4=23,72%.500/98=1,21 mol
P2O5 + 3H2O → 2H3PO4
1 3 2
nH3PO4=2+1,21=3,21 mol => C% H3PO4 (dd A) = 3,21.98/(142+500)=49%

Đáp án C
Ta có: nP2O5= 0,1 mol; mH3PO4 ban đầu= 250.9,8/100=24,5 gam
P2O5+ 3H2O→ 2H3PO4
0,1 0,2 mol
Tổng khối lượng H3PO4 là: 0,2.98+ 24,5=44,1 gam
Khối lượng dung dịch là: 14,2+ 250=264,2 gam
![]()

\(m_{ddH_3PO_4\left(bđ\right)}=250.1,03=257,5\left(g\right)\\ m_{H_3PO_4\left(bđ\right)}=\dfrac{257,5.6}{100}=15,45\left(g\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\\ m_{H_3PO_4\left(thêm\right)}=\dfrac{6}{142}.2.98=\dfrac{588}{71}\left(g\right)\\ C\%_{ddH_3PO_4}=\dfrac{\dfrac{588}{71}+15,45}{257,5+6}.100\approx9,006\%\)
Anh ơi đề có thiếu C% hay thiếu CM của dung dịch ban đầu không ạ?

Chọn đáp án A
Có ![]() mol.
mol.
Phản ứng:
![]()
⇒ ![]() = 2 mol.
= 2 mol.
sẵn có trong 500 gam H3PO4 24,5% là 1,25 mol H3PO4
⇒ sau phản ứng thu được 642 gam dung dịch chứa 3,25 mol H3PO4
⇒ ![]() = 3,25 × 98 ÷ 642 × 100%
= 3,25 × 98 ÷ 642 × 100%
= 49,61%

Đáp án A
P2O5 + 3H2O -> 2H3PO4
1 mol -> 2 mol
=> åmH3PO4 = 98.2 + 500.24,5% = 318,5g
mdd sau = 642g
=> C% H3PO4 = 49,61%

mdd H3PO4 = V. D = 25. 1,03 = 25,75g
mH3PO4(sau phản ứng) = 1,545 + 8,282 = 9,827(g)
Khối lượng dung dịch sau phản ứng = 25,75 + 6 = 31,75(g)