Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(4P+5O_2\rightarrow2P_2O_5\)
b) \(4H_2+Fe_3O_4\rightarrow3Fe+4H_2O\)
c) \(4Ca+6H_3PO_4\rightarrow2Ca_2\left(PO_4\right)_3+9H_2\)

Goi nAl2O3=x mol ,nH2=0,6mol
2Al + 6HCl →2AlCl3 + 3H2
0,4mol<--- 0,4 <--- 0,6mol
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,1mol --->0,2
Ta co: 0,4.27 + x.102 = 21 ==> x=0,1 mol
ΣnAlCl3= 0,4 + 0,2 = 0,6 mol ---> nAl3+=0,6 mol
n↓=0,4 mol
pt ion rut gon giau NaOH tac dung voi dd A
Al3+ +3OH- → Al(OH)3↓
0,12<----- 0,4
==> VNaOH= 0,12:0,5 = 2,4lit==> A

nH2=11,2/22,4=0,5 mol
nH2O=13,5/18=0,75 mol
\(CH2=CH-CHO\)+\(H2\) => \(CH3CH2CH2OH\)
\(Na+H2O\rightarrow NaOH+\frac{1}{2}H_2\)
0,75 mol\(\Leftarrow\)0,75 mol \(\Rightarrow\)0,375 mol
\(CH3CH2CH2OH\)+\(Na\rightarrow CH3CH2CH2ONa+\frac{1}{2}H2\)
0,25 mol\(\Leftarrow\) 0,25 mol\(\Leftarrow\) 0,25 mol\(\Leftarrow\) 0,125 mol
n\(CH3CH2CH2ONa\) =0,25 (mol)= n\(CH3CH2CH2OH\)
=>m\(CH3CH2CH2OH\)=60.0,25=15g
C% của X=15/(15+13,5).100%=52,63%
\(\rightarrow A\)
nH2=11,2/22,4=0,5 mol
nH2O=13,5/18=0,75 mol
CH2=CH−CHO+ H2 => CH3CH2CH2OH
0,25 mol
Na + H2O => NaOH + ½ H2H2
0,75 mol<=0,75 mol =>0,375 mol
CH3CH2CH2OH + Na =>CH3CH2CH2ONa. +½ H2
0,25 mol<= 0,25 mol<= 0,25 mol<= 0,125 mol
nCH3CH2CH2ONa=0,25 mol=nCH3CH2CH2OH
=>mCH3CH2CH2OH=60.0,25=15g
C% của X=15/(15+13,5).100%=52,63% chọn A

TN1. nKOH = 0,22 mol
2KOH + ZnSO4 → Zn(OH)2 + K2SO4 (1)
2KOH + Zn(OH)2 → K2ZnO2 + 2H2O (2)
Gọi x là số mol của Zn(OH)2 phản ứng ở pt (2)
ð Số mol của Zn(OH)2 tạo ra ở pt (1) là \(x+\frac{3a}{99}\); nKOH = 2x + \(2\left(x+\frac{3a}{99}\right)\)= 0,22 mol (1')
TN2. nKOH = 0,28 ; Lượng KOH ở thí nghiệm 2 lớn hơn TN1 là 0,28 – 0,22 = 0,06 mol.
Tương tự như trên ta có: nKOH = (2x + 0,06) + \(2\left(x+0,03+\frac{2a}{99}\right)\)= 0,28 mol (2')
Từ (1') và (2') => x = 0,01 ; a = 2,97 ==> nZnSO4 = = 0,1 mol => mZnSO4 = 161.0,1 = 16,1g

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)

_Dung dịch HCl và HNO3 có pH=1:
=>[H+] = 10^-1 (mol/l)
=>Σ nH{+} = 10^-1*0.1 = 0.01(mol)
+nNaOH = 0.1a (mol)
NaOH => Na{+} + OH{-}
0.1a.........0.1a.......0.1a(mol)
=>nOH{-} = 0.1a (mol)
_Sau phản ứng thu được dung dịch có pH = 12:
+pH = 12:môi trường có tính bazơ => bazơ dư , axit hết.
+pH = 12 => pOH = 14 - 12 = 2 => [OH-] = 10^-2 (mol/l)
=>nOH{-} dư = 10^-2*0.2 = 2*10^-3 (mol)
H{+} + OH{-} => H2O
0.01....0.1a
0.01....0.01........0.01(mol)
..0....0.1a - 0.01.0.01(mol)
=>nOH{-} dư = 0.1a - 0.01 = 2*10^-3 (mol)
<=>0.1a = 0.012
<=>a = 0.12
Vậy a = 0.12 (M)

Chọn đáp án A
Có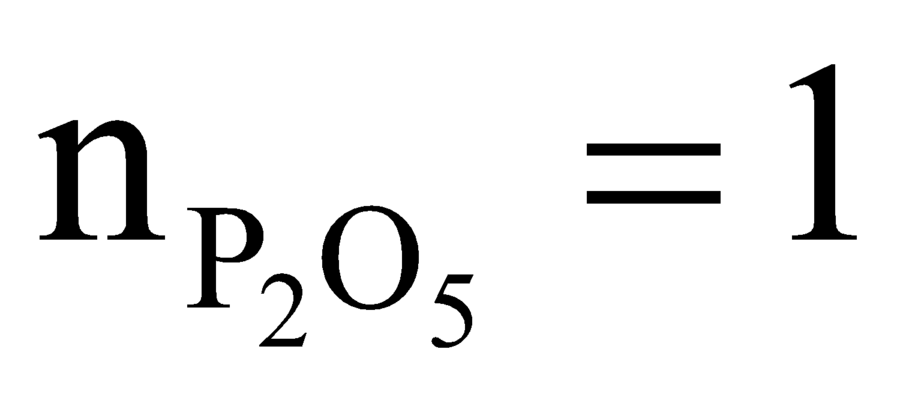 mol.
mol.
Phản ứng:
⇒ = 2 mol.
= 2 mol.
sẵn có trong 500 gam H3PO4 24,5% là 1,25 mol H3PO4
⇒ sau phản ứng thu được 642 gam dung dịch chứa 3,25 mol H3PO4
⇒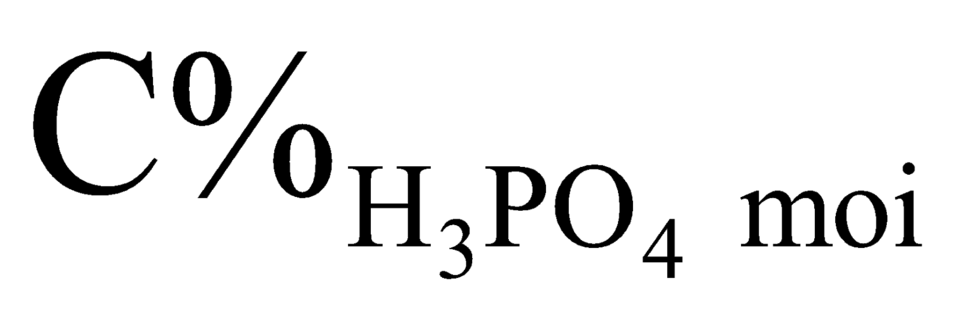 = 3,25 × 98 ÷ 642 × 100%
= 3,25 × 98 ÷ 642 × 100%
= 49,61%