Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
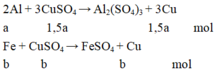
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

Theo đề bài ta có : nCuSO4 = 0,2.0,525 = 0,105 (mol)
Ta có PTHH:
\(Fe+C\text{uS}O4->FeSO4+Cu\)
\(2Al+3CuSO4->Al2\left(SO4\right)3+3Cu\)
Theo 2 PTHH ta có : nCu = nCuSO4 = 0,105 (mol)
Ta có : mA = mFe(dư) + mCu(thu được) => mFe(dư) = 7,84-0,105.64 = 1,12(g) => nFe(dư) = \(\dfrac{1,12}{56}=0,02\left(mol\right)\)
PTHH :
\(Fe+4HNO3->Fe\left(NO3\right)3+NO\uparrow+2H2O\)
0,02mol...0,08mol
\(3Cu+8HNO3->3Cu\left(NO3\right)2+2NO\uparrow+4H2O\)
0,105mol..0,28mol
=> CMddHNO3 = \(\dfrac{\left(0,08+0,28\right)}{2}=0,18\left(l\right)\)
Vậy...

a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b) Ta có: \(\Sigma n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
Gọi số mol của Fe là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\)
Gọi số mol của Al là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=\dfrac{3}{2}b\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}a+\dfrac{3}{2}b=0,135\\56b+27b=4,14\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,045\\b=0,06\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,045\cdot56=2,52\left(g\right)\\m_{Al}=1,62\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{2,52}{4,14}\cdot100\%\approx60,87\%\\\%m_{Al}=39,13\%\end{matrix}\right.\)
c) PTHH: \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\downarrow\)
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{Fe\left(OH\right)_2}=n_{FeCl_2}=0,045mol\\n_{Al\left(OH\right)_3}=n_{AlCl_3}=0,06mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,0225mol\\n_{Al_2O_3}=0,03mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,0225\cdot160=3,6\left(g\right)\\m_{Al_2O_3}=0,03\cdot102=3,06\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{chấtrắn}=3,06+3,6=6,66\left(g\right)\)

PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
\(2NaOH+CuSO_4\rightarrow Na_2SO_4+Cu\left(OH\right)_2\downarrow\)
\(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
a) Ta có: \(n_{NaOH}=2n_{Na_2O}=2\cdot\dfrac{6,2}{62}=0,2\left(mol\right)\) \(\Rightarrow C\%_{NaOH}=\dfrac{0,2\cdot40}{6,2+193,8}\cdot100\%=4\%\)
b) Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,2\left(mol\right)\\n_{CuSO_4}=\dfrac{200\cdot16\%}{160}=0,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,2}{1}\) \(\Rightarrow\) CuSO4 còn dư, tính theo NaOH
\(\Rightarrow n_{Cu\left(OH\right)_2}=0,1\left(mol\right)=n_{CuO}\) \(\Rightarrow m_{CuO}=0,1\cdot80=8\left(g\right)\)
c) PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Theo PTHH: \(n_{HCl}=2n_{CuO}=0,2\left(mol\right)\) \(\Rightarrow V_{ddHCl}=\dfrac{0,2}{2}=0,1\left(l\right)=100\left(ml\right)\)



Kết tủa A gồm 2 kim loại là Cu và Fe dư → CuSO4 và Al phản ứng hết.
n(CuSO4) = 0,525.0,2 = 0,105mol
Theo ĐL bảo toàn nguyên tố: n(Cu) = n(CuSO4) = 0,105mol
Khối lượng Fe dư:
m(Fe dư) = m(A) - m(Cu) = 7,84 - 0,105.64 = 1,12g
Gọi x, y là số mol Al và Fe tham gia pư:
m(hh KL) = m(Al) + m(Fe pư) + m(Fe dư) = 27x + 56y + 1,12 = 4,15g
Cho hh kim loại vài dung dịch CuSO4
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x 3x/2
Fe + CuSO4 → FeSO4 + Cu
y y
n(CuSO4) = 3x/2 + y = 0,105mol
→ x = 0,05mol và y = 0,03mol
Khối lượng mỗi kim loại:
m(Al) = 0,05.27 = 1,35g
m(Fe) = m(Fe pư) + m(Fe dư) = 56.0,03 + 1,12 = 2,8g
A chứa 2 kim loại là Cu và Fe dư →Al phản ứng hết,Fe phản ứng một phần ,Cu2 bị khử hết
Đặt a,b,c là số mol Al , Fe phản ứng và Fe dư
→ 27a + 56(b+c) = 4,15
bảo toàn electron → 3a + 2b = 0,105.2
mA= 56c + 0,105.64 = 7,84
Giả hệ → a=0,05 ; b=0,03 ; c=0,02
A gồm Cu (0,105)và Fe dư(0,02)
bảo toàn electron: 2ncu + 3nFe dư = 3nNO
→ nNO = 0,09
→ nHNO3 = 4nNO = 0,36 mol
→ V=180ml