Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 khí là NO và H2. Dễ tính NO = 0.1; H2 = 0.075
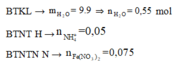
BTNT O →nZnO= 0.2
Đặt nMg = a; nAl =b.
Lập hệ → %nMg = 32%
Đáp án D

Chọn đáp án D.
Khí hóa nâu ngoài không khí là NO.


Gần với giá trị 30 nhất.

Đáp án D
Khí hóa nâu ngoài không khí là NO.
![]() => Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
=> Khí còn lại có phân tử khối < 18 => Khí còn lại là H2.
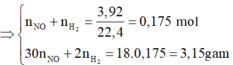
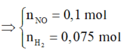
· Áp dụng bảo toàn khối lượng có:
![]()
![]()
Có:
![]()
=> Chứng tỏ có sản phẩm N H 4 + :
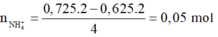
· Áp dụng bảo toàn N có: n F e ( N O 3 ) 2
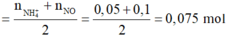
· Áp dụng bảo toàn nguyên tố O có:
![]()
![]()
· Đặt số mol của Mg, Al lần lượt là a, b
![]()
= 8,85
Vì có sản phẩm H2 tạo thành nên sau phản ứng Fe vẫn ở dạng Fe (II).
Áp dụng bảo toàn electron có:
![]()
![]()
Suy ra
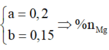
=> 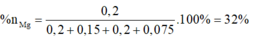
Gần với giá trị 30 nhất.

Đáp án B
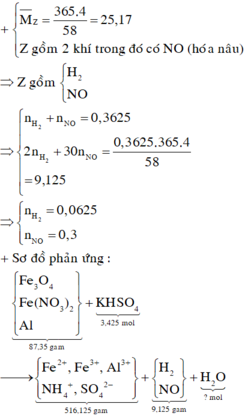
Hỗn hợp khí Z là NO và H2 và
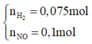
Ta có sơ đồ bài toán như sau:
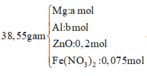


Áp dụng bảo toàn khối lượng ta có:
![]()
![]()
![]()
![]()
Áp dụng bảo toàn nguyên tố H ta có:
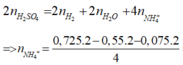
= 0,05 mol
Bảo toàn nguyên tố N:
![]()
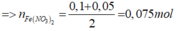
Bảo toàn nguyên tố O:
![]()
![]()
Giả sử dung dịch chỉ chứa Fe2+ áp dụng bảo toàn electron và giả sử ta có hệ sau:
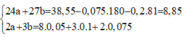
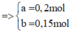

gần nhất với 30%

Chọn đáp án A.
Khí trong Z hóa nâu ngoài không khí là NO.
M Z = 4 , 5 . 4 = 18 < M NO => Khí còn lại có PTK < 18 => Khí đó là H2.

Đặt số mol của Mg, Al, ZnO lần lượt là x, y, z
Có khí H2 thoát ra nên sau phản ứng số mol Fe2+ không đổi.



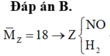
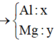
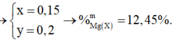

Đáp án C