Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

600ml = 0,6l
600ml = 0,6l
\(n_{H2SO4}=1.0,6=0,6\left(mol\right)\)
\(n_{BaCl2}=0,5.0,6=0,3\left(mol\right)\)
Pt : \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4|\)
1 1 2 1
0,6 0,3 0,6 0,3
a) Lập tỉ số so sánh : \(\dfrac{0,6}{1}>\dfrac{0,3}{1}\)
⇒ H2SO4 dư , BaCl2 phản ứng hết
⇒ Tính toán dựa vào số mol của BaCl2
\(n_{BaSO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
⇒ \(m_{BaSO4}=0,3.233=69,9\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,3.2}{1}=0,6\left(mol\right)\)
\(n_{H2SO4\left(dư\right)}=0,6-0,3=0,3\left(mol\right)\)
\(V_{ddspu}=0,6+0,6=1,2\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0,6}{1,2}=0,5\left(M\right)\)
\(C_{M_{H2SO4\left(dư\right)}}=\dfrac{0,3}{1,2}=0,25\left(M\right)\)
Chúc bạn học tốt

Bài 4:
PTHH: \(Na_2O+H_2O\rightarrow2NaOH\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
a) Ta có: \(n_{Na_2O}=\dfrac{15,5}{62}=0,25\left(mol\right)\) \(\Rightarrow n_{NaOH}=0,5\left(mol\right)\)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,5}{0,5}=1\left(M\right)\)
b) Theo PTHH: \(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,25\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,25\cdot98}{20\%}=122,5\left(g\right)\) \(\Rightarrow V_{ddH_2SO_4}=\dfrac{122,5}{1,14}\approx107,46\left(ml\right)\)

Ta có: \(\text{nHNO3=0,2.1=0,2 mol}\)
\(\text{nHCl=0,3.0,5=0,15 mol}\)
\(\text{nAgNO3=0,25.1=0,25 mol}\)
Cho X tác dụng với AgNO3
HCl + AgNO3\(\rightarrow\) AgCl kt + HNO3
Vì nAgNO3 > nHCl nên AgNO3 dư
\(\rightarrow\) nAgCl=nHCl=0,15 mol \(\rightarrow\)\(\text{m=0,15.(108+35,5)=21,525 gam}\)
Sau phản ứng dung dịch chứa HNO3 và AgNO3 dư
nHNO3=0,2+nHNO3 mới tạo ra\(\text{=0,2+0,15=0,35 mol}\)
nAgNO3 dư=0,25-0,15=0,1 mol
V dung dịch sau phản ứng\(\text{=0,2+0,3+0,25=0,75 lít}\)
CM HNO3=\(\frac{0,35}{0,75}\)=0,467M;
CM AgNO3 dư=\(\frac{0,1}{0,75}\)=0,1333M
nNaOH=nHNO3 + nAgNO3\(\text{=0,35+0,1=0,45 mol}\)
\(\rightarrow\) V NaOH=\(\frac{0,45}{0,5}\)=0,9 lít

Thể tích của dung dịch bari clorua
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{240}{1,20}=200\left(ml\right)\)
200ml = 0,2l
Số mol của dung dịch bari clorua
CMBaCl2 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,2=0,2\left(mol\right)\)
Khối lượng của muối natri sunfat
C0/0Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{14,2.400}{100}=56,8\left(g\right)\)
Số mol của muối natri sunfat
nNa2SO4 = \(\dfrac{m_{Na2SO4}}{M_{Na2SO4}}=\dfrac{56,8}{142}=0,4\left(mol\right)\)
Pt : BaCl2 + Na2SO4 → BaSO4 + 2NaCl\(|\)
1 1 1 2
0,2 0,4 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,4}{1}\)
⇒ BaCl2 phản ứng hết , Na2SO4 dư
⇒ Tính toán dựa vào số mol BaCl2
Số mol của dung dịch bari sunfat
nBaSO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của dung dịch bari sunfat
mBaSO4 = nBaSO4 . MBaSO4
= 0,2 . 233
= 46,6 (g)
Số mol dư của dung dịch natri sunfat
ndư = nban đầu - nmol
= 0,4 - (0,2 . 1)
= 0,2 (mol)
Khối lượng dư của dung dịch natri sunfat
mdư = ndư . MNa2SO4
= 0,2 . 142
= 28,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mBaCl2 + mNa2SO4 - mBaSO4
= 240 + 400 - 46,6
= 593,4 (g)
Nồng độ phần trăm của dung dịch bari sunfat
C0/0BaSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{46,6.100}{593,4}=7,85\)0/0
Nồng độ phần trăm của dung dịch Natri sunfat
C0/0Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{28,4.100}{593,4}=4,78\)0/0
Chúc bạn học tốt

a) BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
\(V_{ddBaCl_2}=\dfrac{240}{1,2}=200\left(ml\right)=0,2\left(l\right)\)
\(\Rightarrow n_{BaCl_2}=0,2\times1=0,2\left(mol\right)\)
\(m_{Na_2SO_4}=400\times14,2\%=56,8\left(g\right)\)
\(\Rightarrow n_{Na_2SO_4}=\dfrac{56,8}{142}=0,4\left(mol\right)\)
Theo PT: \(n_{BaCl_2}=n_{Na_2SO_4}\)
Theo bài: \(n_{BaCl_2}=\dfrac{1}{2}n_{Na_2SO_4}\)
Vì \(\dfrac{1}{2}< 1\) ⇒ BaCl2 hết, Na2SO4 dư
b) Dung dịch A gồm: NaCl và Na2SO4 dư
Theo PT: \(n_{BaSO_4}=n_{BaCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,2\times233=46,6\left(g\right)\)
\(\Rightarrow m_{dd}saupư=240+400-46,6=593,4\left(g\right)\)
Theo PT: \(n_{NaCl}=2n_{BaCl_2}=2\times0,2=0,4\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,4\times58,5=23,4\left(g\right)\)
\(\Rightarrow C\%_{NaCl}=\dfrac{23,4}{593,4}\times100\%=3,94\%\)
Theo PT: \(n_{Na_2SO_4}pư=n_{BaCl_2}=0,2\left(mol\right)\)
\(\Rightarrow n_{Na_2SO_4}dư=0,4-0,2=0,2\left(mol\right)\)
\(\Rightarrow m_{Na_2SO_4}dư=0,2\times142=28,4\left(g\right)\)
\(\Rightarrow C\%_{Na_2SO_4}dư=\dfrac{28,4}{593,4}\times100\%=4,79\%\)

a)\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
b)Số mol của kẽm là:
\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ : 1 1 1 1 (mol)
số mol : 0,15 0,15 0,15 0,15 (mol)
Khối lượng H2SO4 tham gia phản ứng là:
\(m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
c)Khối lượng của dung dịch H2SO4 là:
\(m_{ddH_2SO_4}=D.V_{dd}=500.1,2=600\left(g\right)\)
Nồng độ phần trăm của dung dịch H2SO4 là:
\(C_{\%H_2SO_4}=\dfrac{m_{H_2SO_4}}{m_{ddH_2SO_4}}.100\%=\dfrac{14,7}{600}.100\%=2,45\%\)
d) Khối lượng của khí H2 là:
\(m_{H_2}=0,15.2=0,3\left(g\right)\)
Khối lượng của ZnSO4 là:
\(m_{ZnSO_4}=0,15.161=24,15\left(g\right)\)
Khối lượng của dung dịch ZnSO4 là:
\(m_{ddZnSO_4}=9,75+600-0,3=609,45\left(g\right)\)
Nồng độ dung dịch của muối sau phản ứng là:
\(C_{\%ZnSO_4}=\dfrac{m_{ZnSO_{\text{4}}}}{m_{ddZnSO_4}}.100\%=\dfrac{24,15}{609,45}.100\%=3,9\%\)

a, \(n_{KOH}=0,15.2=0,3\left(mol\right);n_{H_2SO_4}=0,25.2=0,5\left(mol\right)\)
PTHH: 2KOH + H2SO4 → K2SO4 + 2H2O
Mol: 0,3 0,15 0,15
Ta có: \(\dfrac{0,3}{2}< \dfrac{0,5}{1}\) ⇒ KOH hết, H2SO4 dư
⇒ dd sau pứ làm quỳ tím chuyển thành màu đỏ
b, \(C_{M_{ddH_2SO_4}}=\dfrac{0,5-0,15}{0,15+0,25}=0,875M\)
\(C_{M_{ddK_2SO_4}}=\dfrac{0,15}{0,15+0,25}=0,375M\)

500ml = 0,5l
600ml = 0,6l
\(n_{KOH}=1,8.0,5=0,9\left(mol\right)\)
\(n_{H2SO4}=0,5.0,6=0,3\left(mol\right)\)
Pt : \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O|\)
2 1 1 2
0,9 0,3 0,3
Lập tỉ số so sánh : \(\dfrac{0,9}{2}>\dfrac{0,3}{1}\)
⇒ KOH dư , H2SO4 phản ứng hết
⇒ Tính toán dựa vào số mol của KOH
a) \(n_{K2SO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(n_{KOH\left(dư\right)}=0,9-\left(0,3.2\right)=0,3\left(mol\right)\)
\(V_{ddspu}=0,5+0,6=1,1\left(l\right)\)
\(C_{M_{K2SO4}}=\dfrac{0,3}{1,1}=0,27\left(M\right)\)
\(C_{M_{KOH\left(dư\right)}}=\dfrac{0,3}{1,1}=0,27\left(M\right)\)
b) Dung dịch sau phản ứng chuyển sang màu xanh
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn bổ sung câu b giúp mình :
Dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh
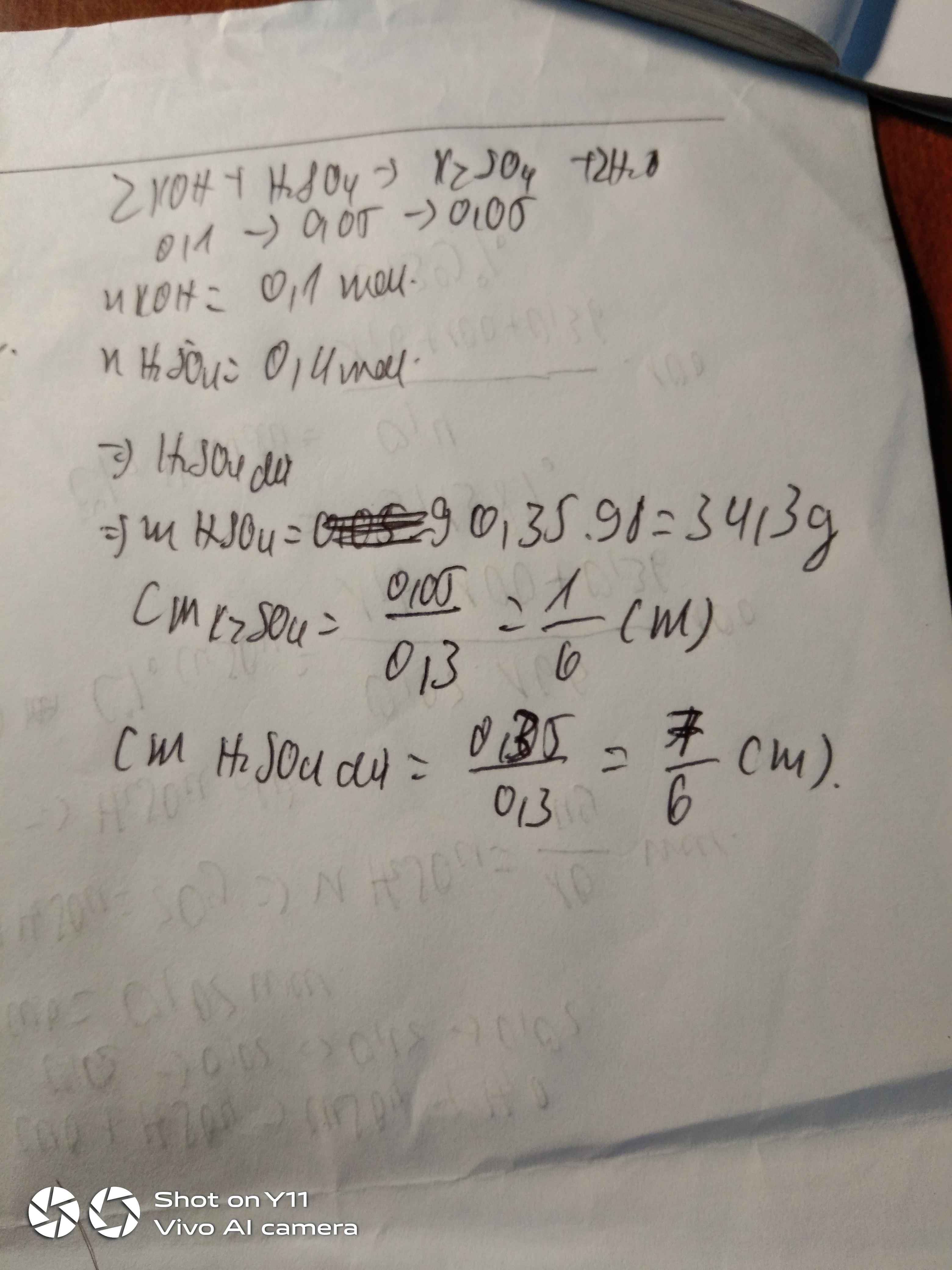
Theo giả thiết ta có :
nNa2CO3=CM.V=2.0,3=0,6 mol
nH2SO4=CM.V=1.0,25=0,25 mol
Ta có pthh
Na2CO3 + H2SO4 \(\rightarrow\) Na2SO4 + H2O + CO2
0,25mol<-----0,25mol----------------------->0,25mol
Ta có tỉ lệ :
\(nNa2CO3=\dfrac{0,6}{1}mol>nH2SO4=\dfrac{0,25}{1}mol\)
=> nNa2CO3 dư ( tính theo số mol của H2SO4 )
Theo giả thiết ta có :
mddH2SO4=V.D=250.1,2=300 g
mct=mNa2SO4=0,25.142 = 35,5 g
mddNa2SO4=mNa2CO3+mddH2SO4-mCO2= (0,6-0,25).106 + 300 - 0,25.44 = 326,1 g
=> CMNa2SO4 = \(\dfrac{n}{V}=\dfrac{0,25}{0,25}=1\left(M\right)\)
=> C%Na2SO4 = \(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{35,5}{326,1}.100\%\approx10,89\%\)