Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
Các chất thỏa mãn là : Al(OH)3, Zn(OH)2, NaHCO3, (NH4)2CO3 ,Na2SO4. →Chọn A

\(n_{NaOH}=0,25.4=1\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=2.0,05=0,1\left(mol\right)\\ PTHH:6NaOH+Al_2\left(SO_4\right)_3\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ Vì:\dfrac{1}{6}>\dfrac{0,1}{1}\\ \Rightarrow NaOHdư\\ \rightarrow n_{Al\left(OH\right)_3}=2.0,1=0,2\left(mol\right)\\ m_{kt}=m_{Al\left(OH\right)_3}=78.0,2=15,6\left(g\right)\)
\(n_{NaOH}=0.25\cdot4=1\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0.05\cdot2=0.1\left(mol\right)\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Lập tỉ lệ :
\(\dfrac{0.1}{1}< \dfrac{1}{6}\) \(\Rightarrow NaOHdư\)
\(n_{NaOH\left(dư\right)}=1-0.6=0.4\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=0.1\cdot2=0.2\left(mol\right)\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(n_{NaOH}>n_{Al\left(OH\right)_3}\)
=> Kết tủa tan hoàn toàn
\(m_{\downarrow}=0\)

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
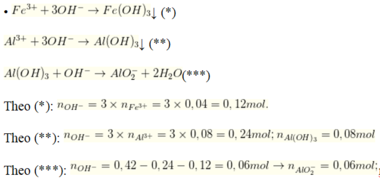
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

Chọn đáp án D
Các chất lần lượt là Al, Al(OH)3, Zn(OH)2, NaHCO3.

Đáp án B
Các chất đó là: Al; Al2O3; Zn(OH)2; ZnO; NH4HCO3; NH4H2PO4; NaHS; KHCO3 và (NH4)2CO3.

Chọn đáp án B
Chú ý : Chất vừa tác dụng với axit vừa tác dụng với kiềm chưa chắc đã phải chất lưỡng tính.
Các chất lưỡng tính : Al2O3 , Zn(OH)2 , NaHS , (NH4)2CO3
Các chất có phản ứng với dung dịch HCl, dung dịch NaOH là:
Al2O3 , Zn(OH)2 , NaHS , (NH4)2CO3, Al

Đáp án C
Các chất thỏa mãn là: Al, Al2O3, Zn(OH)2, NaHS, (NH4)2CO3.

Đáp án B
6NH3+ Al2(SO4)3+ 6H2O→ 2Al(OH)3+3 (NH4)2SO4 (1)
NaOH + Al(OH)3 → NaAlO2+ H2O (2)
Có nAl(OH)3= nNaOH= 0,01.2= 0,02 mol
→ nAl2(SO4)3= 1 2 . nAl(OH)3= 0,01 mol
→ CM Al2(SO4)3= 0,01/ 0,02= 0,5M