Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
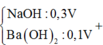


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam

Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Đáp án B
Xét NaOH +X
tạo 0,52 mol NaCl và 0,14 mol N a 2 S O 4 và dư 0,05 mol N a +
Ghép với A l O 2 - ⇒ tạo 0,05 mol N a A l O 2
Đặt n A l = x ; n M g = y
![]()
![]()
Giải hệ có: ![]()
![]()
TH1: B a S O 4 đạt cực đại
⇒ n B a ( O H ) 2 = n S O 4 = 0 , 14 m o l
⇒ n K O H = 0 , 14 . 8 = 1 , 12 m o l
Ghép tương tự NaOH, ta thấy B a 2 + , K + , S O 4 2 - , C l - còn dư 0,6 mol điện tích
Ghép với A l O 2 - ⇒ ghép được 0,15 mol
⇒ vẫn chưa đủ ⇒ còn O H - dư
Rắn gồm 0,14 mol B a S O 4 ; 0 , 15 m o l M g O ⇒ mrắn =38,62g
TH2: A l ( O H ) 3 đạt cực đại
⇒ các ion trong dung dịch gồm B a 2 + , K + , S O 4 2 - , C l -
(ta đang giả sử B a 2 + , S O 4 2 - cùng tồn tại trong cùng 1 dung dịch)
Đặt n B a 2 + = a ⇒ n K + = 8 a
Bảo toàn điện tích:
![]()
n B a S O 4 = n B a 2 + = 0 , 08 m o l
![]()
![]()
⇒ mrắn tối đa =38,62 (g)

Đáp án B
• ![]()
• Đặt số mol Mg, Al lần lượt là a, b => 24a + 27b = 7,65 g (1)
Có n NaOH = 0 , 85 > 0 , 52 + 2 . 0 , 14 = 0 , 8
=> Chứng tỏ Al(OH)3 bị hòa tan một phần: n AlO 2 - = 0 , 85 - 0 , 8 = 0 , 05 mol
⇒ m ↓ = m Mg ( OH ) 2 + m Al ( OH ) 3 = 58 a + 78 . ( b - 0 , 05 ) = 16 , 5 g (2)
• Từ (1) và (2) suy ra a = b = 0,15
• Đặt V (lít) là thể tích dung dịch kiềm thêm vào.
⇒ n B a 2 + = 0 , 1 V , n OH - = ( 0 , 8 + 2 . 0 , 1 ) V = V
P Lượng hiđroxit thu được cực đại khi: n OH - = n H + ⇒ V = 0 , 8 ( l )
Khi đó: n B a 2 + = 0 , 08 mol < n SO 4 2 - = 0 , 14 mol
⇒ m ↓ = 58 . 0 , 15 + 78 . 0 , 15 + 233 . 0 , 08 = 39 , 04 g
P Lượng BaSO4 thu được cực đại khi: n Ba 2 + = n SO 2 - = 0 , 14 mol ⇒ n OH - = 1 , 4 mol
Khi đó: n OH - > n H + + n Al ⇒ Al ( OH ) 3 tan hết
⇒ m ↓ = 58 . 0 , 15 + 233 . 0 , 14 = 41 , 32 g > 39 , 04 g
=> Lượng kết tủa đạt cực đại khi V = 1,4 lít
⇒ m ↓ = m MgO + m B a S O 4 = 40 . 0 , 15 + 233 . 0 , 14 = 38 , 62 g
Gần nhất với giá trị 38,6

Đáp án A
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol;
Vì n N a O H > n N a C l + 2 n N a 2 S O 4 nên còn N a A l O 2
Bảo toàn Na có n N a O H = n N a C l + 2 n N a 2 S O 4 + n N a A l O 2 → 0 , 85 = 0 , 52 + 2 . 0 , 14 + n N a A l O 2
→ n N a A l O 2 = 0,05 mol
Kết tủa thu được là M g ( O H ) 2 : x mol và A l ( O H ) 3 : y mol
Ta có hệ sau
→ dd X có A l + 3 : 0 , 15 m o l ; M g + 2 : 0 , 15 m o l ; C l - : 0 , 52 m o l ; S O 4 2 - : 0 , 14 m o l
Ta thấy X có 3 n A l + 2 n M g < n C l + 2 n S O 4 nên X có dư H + → n H + = 0,52 + 0,14.2 -0,15.3 -0,15.2 = 0,05 mol
OH- + H + → H2O
OH- + M g + 2 → M g ( O H ) 2
3OH- + A l + 3 → A l ( O H ) 3
B a 2 + + S O 4 2 - → B a S O 4
A l ( O H ) 3 + O H - → A l O 2 - + 2 H 2 O
Khi thêm 8x mol KOH và x mol B a ( O H ) 2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau
TH1 : kết tủa có B a S O 4 : 0,14 mol và M g ( O H ) 2 : 0,15 mol và có thể có A l ( O H ) 3
Bảo toàn Ba có x = 0,14 mol → n O H =8x + 2x =10x =1,4 mol > 2 n M g + 4 n A l + n H + = 0,95
→ phản ứng có kết tủa A l ( O H ) 3 bị hòa tan hết → kết tủa thu được là B a S O 4 và M g ( O H ) 2
→ đem nung thu được B a S O 4 : 0,14 mol và MgO : 0,15 mol → m = 38,62g
TH2: Kết tủa có A l ( O H ) 3 : 0,15 mol và Mg(OH)2: 0,15 mol; B a S O 4
Ta có n O H = 10x = 0,15.3 + 0,15.2 +0,05=0,8 → x = 0,08 mol→ có 0,08 mol B a S O 4
→ Đem nhiệt phân thu được 0,08 mol B a S O 4 ; 0,075 mol Al2O3 và 0,15mol MgO
→ m = 0,08.233 + 0,075.102 +0,15.40 =32,29g
Nên TH1 khối lượng kết tủa lớn nhất là 38,62 g gần nhất với 38,6 nhất

Giải thích:
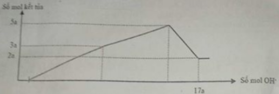
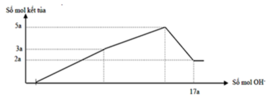
Dd X + NaOH → Mg(OH)2 + Al(OH)3
Lượng kết tủa khi NaOH dư là nMg(OH)2 = 2a
→ lượng kết tủa tối đa là nAl(OH)3 = n↓ - nMg(OH)2 = 5a - 2a =3a
→ nMg : nAl2O3 = 2a : = 4 : 3
Mà mhỗn hợp = 24nMg + 102nAl2O3 = 12,06 → nMg = 0,12 mol và nAl2O3 = 0,09 mol
→ a = 0,06 mol → nOH = 17a = 1,02 = nH+ (X) + 2nMg + 8nAl2O3 = nH+(X) + 0,96 → nH+(X) = 0,06 mol
Bảo toàn điện tích trong dung dịch X có nH+(X) + 2nMg2+ + 3nAl3+ = nCl- + 2nSO4 = 0,84
Mà nCl : nSO4 = 5 : 1 nên nCl- = 0,6 mol và nSO4 = 0,12 mol
X có Cl- : 0,6 mol SO42- : 0,12 mol, H+ : 0,06 mol, Al3+ : 0,18 mol và Mg2+ : 012 mol
Dd thêm vào có Ba2+ : x mol, Na+ : 3x mol ; OH- : 5x mol
Để thu được kết tủa tối đa thì ta có tạo kết tủa Al(OH)3 và Mg(OH)2 tối đa
nOH- = 5x = 0,18.3 +0,12.2 =0,78 mol
Khi đó Ba2+ : 0,156 → nBaSO4= 0,12 → ↓ BaSO4 : 0,12 mol; Al(OH)3 : 0,18 mol; Mg(OH)2 : 0,12 mol
→ nung thu được 0,12 mol BaSO4; 0,09 mol Al2O3 và 0,12 mol MgO
→ m =41,94
Đáp án D

Đáp án A
TN1:
nNaOH = 2nNa2CO3 = 0,5 mol
Giả sử số mol peptit là x mol => nH2O sau phản ứng = x mol
BTKL: mpeptit + mNaOH = m muối + mH2O => m+0,5.40 = m + 18,2 + 18x => x = 0,1 mol
=> X là pentapeptit
TN2: nX = (nHCl – nNaOH)/5 = (1,04 – 0,04)/5 = 0,2 mol
Giả sử X là GlyaAlabValc (a+b+c = 5)
Muối gồm:
NaCl: 0,04 mol
Gly-HCl: 0,2a
Ala-HCl: 0,2b
Val-HCl: 0,2c
=> 111,5.0,2a + 125,5.0,2b + 153,5.0,2c + 0,04.58,5 = 125,04
=> 223a + 151b + 307c = 1227
Khảo sát nhận thấy chỉ có c = 1; a = 3; b = 1 thỏa mãn
Vậy X là Gly3AlaVal
Xét đáp án A:
0,1 mol X tác dụng với NaOH vừa đủ thu được 54,1 gam muối Z (Gly-Na (0,3 mol), Ala-Na (0,1 mol), Val-Na (0,1 mol)) chứa 29,1 gam Gly-Na
=> 27,05 gam Z chứa 14,55 gam Gly-Na => Sai
Xét đáp án B: a = 0,2.(75.3+89+117-18.4) = 71,8 gam => Đúng
Xét đáp án C: X có chứa 1 phân tử Ala => Đúng
Xét đáp án D: X có CTPT: C14H25O6N5
%mO = 16.6/359 = 26,74% => Đúng

Đáp án A
TN1:
nNaOH = 2nNa2CO3 = 0,5 mol
Giả sử số mol peptit là x mol => nH2O sau phản ứng = x mol
BTKL: mpeptit + mNaOH = m muối + mH2O => m+0,5.40 = m + 18,2 + 18x => x = 0,1 mol
=> X là pentapeptit
TN2: nX = (nHCl – nNaOH)/5 = (1,04 – 0,04)/5 = 0,2 mol
Giả sử X là GlyaAlabValc (a+b+c = 5)
Muối gồm:
NaCl: 0,04 mol
Gly-HCl: 0,2a
Ala-HCl: 0,2b
Val-HCl: 0,2c
=> 111,5.0,2a + 125,5.0,2b + 153,5.0,2c + 0,04.58,5 = 125,04
=> 223a + 151b + 307c = 1227
Khảo sát nhận thấy chỉ có c = 1; a = 3; b = 1 thỏa mãn
Vậy X là Gly3AlaVal
Xét đáp án A:
0,1 mol X tác dụng với NaOH vừa đủ thu được 54,1 gam muối Z (Gly-Na (0,3 mol), Ala-Na (0,1 mol), Val-Na (0,1 mol)) chứa 29,1 gam Gly-Na
=> 27,05 gam Z chứa 14,55 gam Gly-Na => Sai
Xét đáp án B: a = 0,2.(75.3+89+117-18.4) = 71,8 gam => Đúng
Xét đáp án C: X có chứa 1 phân tử Ala => Đúng
Xét đáp án D: X có CTPT: C14H25O6N5
%mO = 16.6/359 = 26,74% => Đúng
0,02 mol Ba(OH)2 và 0,02 mol NaOH + 0,0005x mol H2SO4
Dung dịch thu được có pH = 1 => Phản ứng dư axit.
Khối lượng kết tủa BaSO4 tối đa thu được =233.0,02=4,66 gam
=> Chọn đáp án D.