Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Ca\left(OH\right)_2}=0,2.1=0,2\left(mol\right)\\ n_{HCl}=\dfrac{73.10\%}{36,5}=0,2\left(mol\right)\\ Ca\left(OH\right)_2+2HCl\rightarrow CaCl_2+2H_2O\\ Vì:\dfrac{0,2}{2}< \dfrac{0,2}{1}\)
=> Ca(OH)2 dư
=> Dung dịch sau phản ứng có: Ca(OH)2 dư và CaCl2
\(m_{Ca\left(OH\right)_2\left(dư\right)}=\left(0,2-\dfrac{0,2}{2}\right).74=7,4\left(g\right)\)
- Nhúng quỳ tím vào dd thu được quỳ tím đổi màu xanh.

\(n_{NaOH}=2.0,2=0,4\left(mol\right)\\ n_{HCl}=0,2.1=0,2\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ Vì:\dfrac{0,2}{1}< \dfrac{0,4}{1}\Rightarrow NaOHdư\)
=> Quỳ tím hoá xanh => C

\(\left\{{}\begin{matrix}n_{HCl}=0,1.2=0,2\left(mol\right)\\n_{NaOH}=0,2.1,5=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: NaOH + HCl ---> NaCl + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow\) NaOH dư
`=>` ddA làm QT đổi sang màu xanh

Dung dịch sau phản ứng có chứa NaOH hay HNO 3 dư sẽ quyết định màu của quỳ tím.
- Số mol các chất đã dùng :
n NaOH = 10/40 mol; n HNO 3 = 10/63 mol
- Số mol NaOH nhiều hơn số mol HNO 3 . Theo phương trình hoá học, ta thấy khi phản ứng kết thúc, trong dung dịch còn dư NaOH. Do vậy, dung dịch sau phản ứng làm cho quỳ màu tím chuyển thành màu xanh.
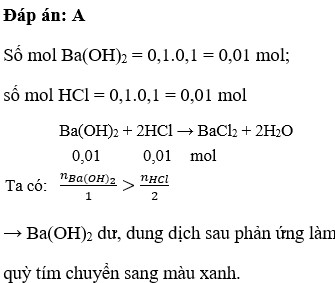
\(n_{HCl}=0,2.3=0,6\left(mol\right);n_{Ba\left(OH\right)_2}=0,1.1,5=0,15\left(mol\right)\)
PTHH: Ba(OH)2 + 2HCl ---> BaCl2 + 2H2O
Xét tỉ lệ: \(\dfrac{0,6}{2}>\dfrac{0,15}{1}\Rightarrow\) HCl dư
=> dd sau phản ứng làm QT hóa đỏ