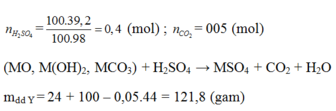Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 2:
Gọi khối lượng của ddNaCl 2% và 10% lần lượt là m1 và m2
\(m_{NaCl\left(1\right)}=\dfrac{2}{100}m_1;m_{NaCl\left(2\right)}=\dfrac{10}{100}m_2\)
\(\Rightarrow m_{NaCl\left(3\right)}=\dfrac{2}{100}m_1+\dfrac{10}{100}m_2=0,02m_1+0,1m_2\) (1)
\(m_{ddNaCl\left(3\right)}=m_1+m_2\)
Ta có: \(m_{NaCl\left(3\right)}=\dfrac{8.\left(m_1+m_2\right)}{100}=0,08\left(m_1+m_2\right)\) (2)
Từ (1)(2)
\(\Rightarrow0,02m_1+0,1m_2=0,08m_1+0,08m_2\)
\(\Leftrightarrow0,02m_2=0,06m_1\Rightarrow\dfrac{m_1}{m_2}=\dfrac{0,02}{0,06}=\dfrac{1}{3}\)
Câu 1:
\(n_{KOH}=2,4.160=384\left(mol\right)\)
\(V_{ddKOH2M}=\dfrac{384}{2}=192\left(l\right)\)
⇒ Vnước thêm vào = 192-160 = 32 (l)

Đáp án D
Gọi số mol HCl là x mol
HCl + KOH → KCl + H2O
x x (mol)
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525 ⇒KOH dư ,HCl hết.
(0,1 - x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M

Câu 2 :
$n_{HCl} = 0,2.1 + 0,3.1,5 = 0,65(mol)$
$V_{dd} = 0,2 + 0,3 = 0,5(mol)$
$C_{M_{HCl}} = \dfrac{0,65}{0,5} =1,3M$
Câu 3 :
Gọi $m_{H_2O\ cần\ thêm} =a (gam)$
Sau khi thêm :
$m_{NaOH} = 100.35\% = 35(gam)$
$m_{dd} = 100 + a(gam)$
Suy ra: $\dfrac{35}{100 + a}.100\% = 20\%$
Suy ra: a = 75(gam)
Câu 4 :
Gọi $V_{dd\ HCl\ 2M} =a (lít) ; V_{dd\ HCl\ 3M} = b(lít)$
Ta có :
$a + b = 4$
$2a + 3b = 4.2,75$
Suy ra a = 1(lít) ; b = 3(lít)

\(a,PTHH:X+2HCl\to XCl_2+H_2\\ \Rightarrow n_{X}=n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ \Rightarrow M_X=\dfrac{9,75}{0,15}=65(g/mol)(Zn)\\ b,n_{HCl}=2.0,2=0,4(mol)\)
Vì \(\dfrac{n_{H_2}}{1}<\dfrac{n_{HCl}}{2}\) nên \(HCl\) dư
\(\Rightarrow n_{ZnCl_2}=n_{H_2}=0,15(mol)\\ \Rightarrow m_{ZnCl_2}=136.0,15=20,4(g)\\ C_{M_{ZnCl_2}}=\dfrac{0,15}{0,2}=0,75M\)

MnO 2 + HCl → MnCl 2 + Cl 2 + 2 H 2 O
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
n MnO 2 = 0,2 mol; n NaOH = 0,729 mol
Theo phương trình (1) ta có: n Cl 2 = n MnO 2 = 0,2 mol
Theo phương trình (2) ta có: 2 n Cl 2 < n NaOH ⇒ NaOH dư
Dung dịch A gồm: n NaCl = n NaClO = n Cl 2 = 0,2 mol
n NaOH dư = 0,729 – 2.0,2 = 0,329 mol
m dd A = m Cl 2 + m dd NaOH = 0,2.71 + 145,8 = 160g
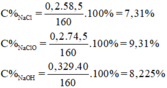

Câu 2:
\(m_{H_2SO_4}=39,2.25\%=9,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
\(m_{NaOH}=16.30\%=4,8\left(g\right)\Rightarrow n_{NaOH}=\dfrac{4,8}{40}=0,12\left(mol\right)\)
PTHH: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Mol: 0,06 0,12 0,06
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,12}{2}\) ⇒ H2SO4 dư, NaOH hết
mdd sau pứ = 39,2+16 = 55,2 (g)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,1-0,06\right).98.100\%}{55,2}=7,1\%\)
\(C\%_{ddNa_2SO_4}=\dfrac{0,06.142.100\%}{55,2}=15,43\%\)
Câu 3.
a)\(n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\)
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: 0,1 0,1 0,1
mdd sau pứ = 13,7+250.1,008-0,1.2 = 265,5 (g)
\(C\%_{ddBa\left(OH\right)_2}=\dfrac{0,1.171.100\%}{265,5}=6,44\%\)