Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A
Cách 1:
Giả thiết hỗn hợp ban đầu được tạo ra từ a mol Fe và b mol O 2
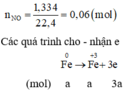

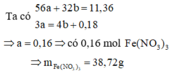
Cách 2:
Quy đổi hỗn hợp về Fe (x mol) và O (y mol)
→ 56x + 16y = 11,36 mol (1)
Bảo toàn e: 3nFe = 2nO + 3 nNO
→ 3x – 2y = 0,18 (2)
Từ (1)(2) → x = 0,16; y = 0,15
Số mol NO3- = ne cho = 3 nFe = 0,48 mol
mmuối = mFe + mNO3- = 0,16.56 + 0,48.62 = 38,72g

PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{FeCl_2}=n_{Fe}=0,2\left(mol\right)\\n_{HCl}=2n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
a, Ta có: \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(V_{ddHCl}=\dfrac{0,4}{1,5}\approx0,267\left(l\right)\)
c, \(m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
Bạn tham khảo nhé!

Đáp án D
Với dạng toán này ta chỉ cần bảo toàn electron mà không cần xác định kim loại M.


Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
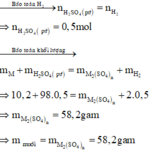
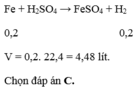




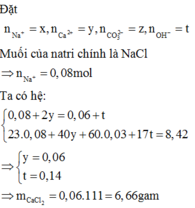
a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe^0 \to Fe^{+3} + 3e$
$N^{+5} + 3e \to N^{+2}$
Bảo toàn electron : $3n_{Fe} = 3n_{NO}$
$\Rightarrow n_{NO} = 0,2(mol)$
$\Rightarrow V = 0,2.22,4 = 4,48(lít)$
b) $n_{Fe(NO_3)_3} = n_{Fe} = 0,2(mol)$
$\Rightarrow m = 0,2.242 = 48,4(gam)$