Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,Mg+2HCl\rightarrow MgCl_2+H_2\\ b,n_{Mg}=\dfrac{12}{24}=0,5mol\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,5mol\\ V_{H_2}=0,5.24,79=12,395l\\ c,n_{HCl}=0,5.2=1mol\\ C_{M_{HCl}}=\dfrac{1}{0,1}=10M\\ d,m_{MgCl_2}=0,5.95=47,5g\)
`#3107.101107`
`a,`
PTHH: \(\text{Mg}+\text{2HCl}\rightarrow\text{ MgCl}_2+\text{H}_2\)
`b,`
n của Mg trong pứ là:
\(\text{n}_{\text{Mg}}=\dfrac{\text{m}_{\text{Mg}}}{\text{M}_{\text{Mg}}}=\dfrac{12}{24}=\dfrac{1}{2}=0,5\left(\text{mol}\right)\)
Theo pt: `1` mol Mg thu được `1` mol H2
`=>`\(\text{n}_{\text{H}_2}=0,5\left(\text{mol}\right)\)
Thể tích của H2 thu được sau pứ là:
\(\text{V}_{\text{H}_2}=\text{n}_{\text{H}_2}\cdot24,79=0,5\cdot24,79=12,395\left(l\right)\)
c.
Đổi `100` ml = `0,1` l
Theo PT: `1` mol Mg tác dụng với `2` mol HCl được pứ trên
`=>`\(\text{n}_{\text{HCl}}=2\cdot0,5=1\left(\text{mol}\right)\)
Nồng độ `%` của HCl là:
\(\text{C}_{\text{M}}=\dfrac{\text{n}_{HCl}}{\text{V}_{\text{HCl}}}=\dfrac{1}{0,1}=10\left(\text{M}\right)\)
d.
Theo PT: `1` mol Mg thu được `1` mol MgCl2
`=>`\(\text{n}_{\text{MgCl}_2}=0,5\text{ (mol)}\)
m của MgCl2 thu được sau pứ là:
\(\text{m}_{\text{MgCl}_2}=\text{n}_{\text{MgCl}_2}\cdot\text{M}_{\text{MgCl}_2}=0,5\cdot95=47,5\left(g\right).\)

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(C_{M_{FeSO_4}}=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
PTHH: Fe + H₂SO₄ --> FeSO₄ + H₂
200ml = 0,2 lít.
a) Số mol H₂: nH₂ = 6,72 ÷ 22,4 = 0,3 mol
Theo PTHH => Số mol Fe: nFe = 0,3 mol
=> Khối lượng Fe: mFe = 16,8g
b) Số mol H₂SO₄: nH₂SO₄ = 0,3 mol
Nồng độ mol dd: CM = 0,3 ÷ 0,2 = 1,5M

a, \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,1_____0,2______0,1_____0,1 (mol)
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
\(m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
b, \(C_{M_{HCl}}=\dfrac{0,2}{0,1}=1\left(M\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\), ta được CuO dư.
Theo PT: \(n_{CuO\left(pư\right)}=n_{Cu}=n_{H_2}=0,1\left(mol\right)\Rightarrow n_{CuO\left(dư\right)}=0,05\left(mol\right)\)
⇒ m chất rắn = mCuO (dư) + mCu = 0,05.80 + 0,1.64 = 10,4 (g)

Fe+2HCl->FeCl2+H2
0,125--0,25---0,125-0,125
m HCl=9,125 g=>n HCl=\(\dfrac{9,125}{26,5}\)=0,25 mol
=>m Fe=0,125.56=7g
=>VH2=0,125.22,4=2,8l
=>C%FeCl2=\(\dfrac{0,125.127}{7+182,5-0,25}\).100=8,388%

`a)PTHH`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,125` `0,25` `0,125` `0,125` `(mol)`
`n_[HCl]=[5/100 .182,5]/[36,5]=0,25(mol)`
`b)m_[Fe]=0,125.56=7(g)`
`V_[H_2]=0,125.22,4=2,8(l)`
`c)m_[HCl]=0,25.36,5=9,125(g)`
`m_[FeCl_2]=0,125.127=15,875(g)`
`d)C%_[FeCl_2]=[15,875]/[7+182,5-0,125.2] .100~~8,39%`

\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(.........0.6............0.3\)
\(C_{M_{HCl}}=\dfrac{0.6}{0.3}=2\left(M\right)\)
\(n_{Fe_2O_3}=\dfrac{48}{160}=0.3\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{t^0}}2Fe+3H_2O\)
\(1..............3\)
\(0.3..........0.3\)
\(LTL:\dfrac{0.3}{1}>\dfrac{0.3}{3}\Rightarrow Fe_2O_3dư\)
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}\cdot0.3=0.2\left(mol\right)\)
\(m_{Fe}=0.2\cdot56=11.2\left(g\right)\)

\(n_{Zn}=\dfrac{1,3}{65}=0,02\left(mol\right)\)
PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,02 0,04 0,02 0,02
\(V_{H_2}=0,02.22,4=0,448\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0,04}{4}=0,01M\)
b, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,02 0,02
\(m_{Cu}=0,02.64=1,28\left(g\right)\)

\(a) Fe + 2HCl \to FeCl_2\\ b) n_{HCl} = \dfrac{182,5.5\%}{36,5} = 0,25(mol)\\ n_{FeCl_2} = n_{H_2} = n_{Fe} = \dfrac{1}{2}n_{HCl} = 0,125(mol)\\ \Rightarrow m_{Fe} = 0,125.56 = 7(gam) ; V = 0,125.22,4 = 2,8(lít)\\ c) m_{dd\ sau\ phản\ ứng} = m_{Fe} + m_{dd\ HCl} - m_{H_2} = 7 + 182,5 - 0,125.2 = 189,25(gam)\\ C\%_{FeCl_2} = \dfrac{0,125.127}{189,25}.100\% = 8,39\%\)

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
a)\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6 0,3
\(C_M=\dfrac{0,6}{0,4}=1,5M\)
b)\(n_{CuO}=\dfrac{32}{80}=0,4mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,4 0,3 0,3
Sau phản ứng CuO dư và dư \(\left(0,4-0,3\right)\cdot80=8g\)
\(m_{rắn}=m_{Cu}=0,3\cdot64=19,2g\)
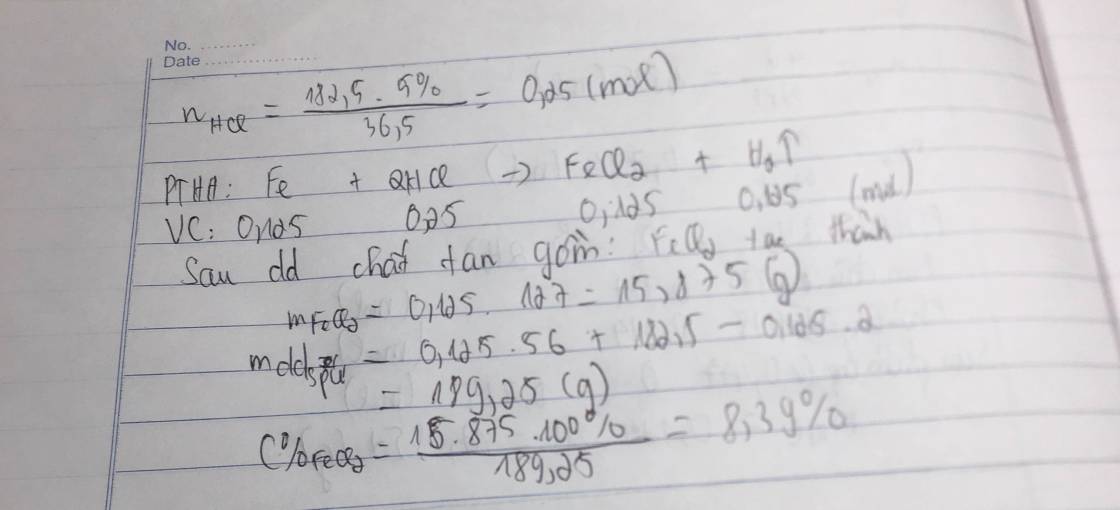
nMg = 6,72 : 22,4 = 0,3 mol
Mg + 2HCl -> MgCl2 + H2
0,3 0,6 0,3
=> mMg = 0,3 . 24 = 7,2 g
CM HCl = 0,6 : 0,5 = 4M