
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(CuCl_2+Ca\left(OH\right)_2\rightarrow Cu\left(OH\right)_2\downarrow+CaCl_2\)
\(Cu\left(OH\right)_2\rightarrow CuO+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\((1)CuO+2HCl\to CuCl_2+H_2O\\ (2)CuCl_2+2NaOH\to Cu(OH)_2\downarrow+2NaCl\\ (3)Cu(OH)_2\xrightarrow{t^o}CuO+H_2O\\ (4)CuO+H_2SO_4\to CuSO_4+H_2O\)

\(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
\(2Fe\left(OH\right)_3\rightarrow Fe_2O_3+3H_2O\)
\(Fe_2O_3+2H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+2H_2O\)
\(Fe_2\left(SO_4\right)_3+3BaCl_2\rightarrow2FeCl_3+3BaSO_4\downarrow\)

\(CaCO_3\xrightarrow{t^o}CaO+CO_2\uparrow\\ CO_2+NaOH\to NaHCO_3\\ NaHCO_3+NaOH\to Na_2Co_3+H_2O\\ Na_2CO_3+Ca(OH)_2\to CaCO_3\downarrow+2NaOH\)

\(n_{HCl}=\dfrac{1}{36,5}=0,027\left(mol\right)\)
\(n_{NaOH}=\dfrac{1}{40}=0,025\left(mol\right)\)
\(HCl+NaOH\rightarrow NaCl+H_2O\)
Lập tỉ lệ : \(\dfrac{0,027}{1}>\dfrac{0,025}{1}\)=> Sau phản ứng HCl dư
Vậy khi nhúng quỳ tím vào dung dịch sau phản ứng, quỳ tím hóa đỏ

Trích các mẫu thử rồi đánh dấu.
Cho dung dịch NaOH vào các mẫu thử:
- Mẫu thử xuất hiện kết tủa màu xanh là CuSO4.
- Mẫu thử còn lại không xảy ra hiện tượng.
PTHH: \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
Cho dd NaOH vào từng lọ, xuất hiện KT xanh lam là CuSO4, ko ht là Na2SO4
\(2NaOH+CuSO_4\to Cu(OH)_2\downarrow+Na_2SO_4\)

\(C+O_2\xrightarrow{t^o}CO_2\\ CO_2+C\xrightarrow{t^o}2CO\\ CO+CuO\xrightarrow{t^o} Cu+CO_2\\ Cu+Cl_2\xrightarrow{t^o}CuCl_2\\ CuCl_2+Ba(OH)_2\to Cu(OH)_2\downarrow+BaCl_2\\ BaCl_2+Na_2CO_3\to BaCO_3\downarrow+2NaCl\\ BaCO_3\xrightarrow{t^o}BaO+CO_2\uparrow\)

Trích mẫu thử, cho quỳ tím vào các mẫu thử:
- Quỳ hóa xanh: \(NaOH,Ba(OH)_2\)
- Quỳ ko đổi màu: \(NaNO_3\)
Sục khí \(CO_2\) vào mẫu thử làm quỳ hóa xanh, sau p/ứ tạo KT trắng là \(Ba(OH)_2\), ko ht là \(NaOH\)
\(Ba(OH)_2+CO_2\to BaCO_3\downarrow+H_2O\)





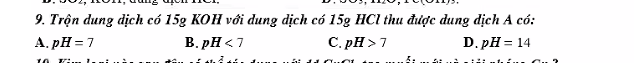
Câu 4 :
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,4 .36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{10}=146\left(g\right)\)
b) Số mol của muối sắt (II) clorua
nFeCl2= \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,2 . 127
= 25,4 (g)
Chúc bạn học tốt
Câu 3 :
200ml = 0,2l
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,2=0,2\left(mol\right)\)
a) Pt : Zn + 2HCl → ZnCl2 + H2\(|\)
1 2 1 1
0,1 0,2 0,1 0,1
b) Số mol của kẽm
nZn = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Khối lượng của kẽm
mZn= nZn . MZn
= 0,1 . 65
= 6,5 (g)
Số mol của khí hidro
nH2= \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tich của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,1 . 22,4
= 2,24 (l)
c) Khối lượng củadung dịch axit clohidric
D = \(\dfrac{m}{V}\Rightarrow m=D.V=1,1.200=220\left(g\right)\)
Khối lượng của dung dịch sau phản ứng mdung dịch sau phản ứng = 6,5 + 220
= 226,5 (g)
Số mol của kẽm clorua
nZnCl2= \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Khối lượng của kẽm clorua
mZnCl2= nZnCl2 . MznCl2
= 0,1. 136
= 13,6 (g)
Nồng độ phần trăm của kẽm clorua
C0/0ZnCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{13,6.100}{226,5}=6\)0/0
Chúc bạn học tốt