Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phải dùng 4,2 g Fe
Cần 6g sắt (III) oxit tác dụng với H2 dư

TL
1/ nAl = 5,4 : 27 = 0,2(mol)
4Al + 3O2 ---> 2Al2O3
0,2 ----> 0,1 (mol)
=> mAl2O3 = 0,1 x ( 27 x 2 + 16 x 3 ) = 0,2 x 102 = 20.4 (g)
2/ nAl2O3 = 30,6 : 102 = 0,3 (mol)
4Al + 3O2 ---> 2Al2O3
0,6 <---- 0,3 (mol)
=> mAl = 0,6 x 27 = 16,2 (g)
3/ B1 : Viết phương trình
B2 : Tính số mol các chất
B3 : Dựa vào phương trình hóa học tính được số mol chất cần tìm
B4 : Tính khối lượng.
Áp dụng: 1. C
2. B
3. B
Khi nào rảnh vào kênh H-EDITOR xem vid nha!!! Thanks!

Sửa lại câu c .
\(n_{H_2SO_4}=\dfrac{49.40}{100}:98=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
trc p/u : 0,3 0,2
p/u : 0,2 0,2 0,2 0,2
sau : 0,1 0 0,2 0,2
-> Fe dư
\(m_{ddFeSO_4}=0,3.56+49-0,4=65,4\left(g\right)\) ( ĐLBTKL )
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(C\%=\dfrac{30,4}{65,4}.100\%\approx46,48\%\)
PTHH :
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,C_M=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(c,n_{H_2SO_4}=\dfrac{\dfrac{49.40}{100}}{98}=0,2\left(mol\right)\)
\(\rightarrow n_{FeSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(m_{ddFeSO_4}=49+\left(0,2.56\right)-0,2.2=59,8\left(g\right)\)( định luật bảo toàn khối lượng )
\(C\%=\dfrac{30,4}{59,8}.100\%\approx50,84\%\)

\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.25....0.25.......................0.25\)
\(m_{Fe}=0.25\cdot56=14\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.25}{0.1}=2.5\left(M\right)\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\a, PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ b,n_{H_2}=n_{H_2SO_4}=n_{Fe}=0,2\left(mol\right)\\ V_{H_2\left(đkc\right)}=0,2.24,79=4,958\left(l\right)\\ c,C_{MddH_2SO_4}=\dfrac{0,2}{0,4}=0,5\left(M\right)\)

Sửa đề : 11.2 g sắt
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.2....0.2.................0.2\)
\(m_{FeSO_4}=0.2\cdot152=30.4\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2}{0.05}=4\left(M\right)\)

\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 < 0,4 ( mol )
0,1 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
\(n_{ZnCl_2}=\dfrac{0,1.1}{1}=0,1mol\)

nhân tiện giải thích rõ giúp mình v trong công thức tính nồng độ mol với ạ, lấy bài trên làm ví dụ luôn nhé! mình không hiểu v ở đây là 200 ml dung dịch hay là tổng thể tích khi cho sắt vào dung dịch kia ấy :_)
mình ghi trong vở là thể tích dung dịch trước phản ứng và sau phản ứng không thay đổi nhưng như trên thì mình không hiểu dung dịch ở đây là tổng thể tích khi đổ sắt vào axit hay chỉ riêng axit. sau phản ứng có hidro bay lên thì mình không biết thể tích nó có bằng nhau hay không
\(a,200ml=0,2l\\ n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right),n_{H_2SO_4}=0,2.0,2=0,04\left(mol\right)\\ Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\\ \Rightarrow\dfrac{0,1}{1}>\dfrac{0,4}{1}\Rightarrow Fedư\\ n_{FeSO_4}=n_{H_2SO_4}=0,04mol\\ m_{FeSO_4}=0,04.416=16,64\left(g\right)\\ b,C_{MFeSO_4}=\dfrac{0,04}{0,2}=0,2\left(M\right)\)
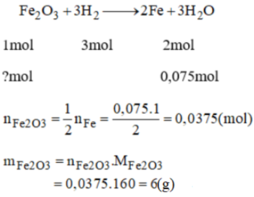


cho em cách giải nx ạ
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH :
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,1 0,1
-> n H2SO4 = 0,1 mol
---> B