Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{MgO}=a\left(mol\right),n_{Fe_2O_3}=b\left(mol\right)\)
\(m=40a+160b=12\left(g\right)\left(1\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(m_{Muối}=120a+400y=32\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\%MgO=\dfrac{0.1\cdot40}{12}\cdot100\%=33.33\%\)
\(\%Fe_2O_3=66.67\%\)
\(m_{dd}=12+200=212\left(g\right)\)
\(C\%_{MgSO_4}=\dfrac{0.1\cdot120}{212}\cdot100\%=5.66\%\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0.05\cdot400}{212}\cdot100\%=9.42\%\)

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
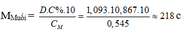
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
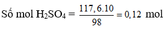
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
a_______a________a______a (mol)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
b_______\(\dfrac{3}{2}\)b_________\(\dfrac{1}{2}\)b_____\(\dfrac{3}{2}\)b (mol)
a) Ta lập HPT: \(\left\{{}\begin{matrix}24a+27b=8,25\\a+\dfrac{3}{2}b=\dfrac{2,24}{22,4}=0,1\end{matrix}\right.\) \(\Leftrightarrow\) Hệ có nghiệm âm
*Bạn xem lại đề !!!

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25(mol)\\ Mg+H_2SO_4\to MgSO_4+H_2\\ MgO+H_2SO_4\to MgSO_4+H_2O\\ \Rightarrow n_{Mg}=0,25(mol)\\ a,\begin{cases} \%_{Mg}=\dfrac{0,25.24}{14}.100\%=42,86\%\\ \%_{MgO}=100\%-42,86\%=57,14\% \end{cases}\\ b,n_{MgO}=\dfrac{14-0,25.24}{40}=0,2(mol)\\ \Rightarrow \Sigma n_{H_2SO_4}=0,2+0,25=0,45(mol)\\ \Rightarrow C\%_{H_2SO_4}=\dfrac{0,45.98}{200}.100\%=22,05\%\)

a, PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,4.27}{14,8}.100\%\approx72,97\%\\\%m_{MgO}\approx27,03\%\end{matrix}\right.\)
b, Ta có: \(n_{MgO}=\dfrac{14,8-0,4.27}{40}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}+n_{MgO}=0,7\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,7.98=68,6\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{68,6}{10\%}=686\left(g\right)\)
c, Theo PT: \(\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,2\left(mol\right)\\n_{MgSO_4}=n_{MgO}=0,1\left(mol\right)\end{matrix}\right.\)
Ta có: m dd sau pư = 14,8 + 686 - 0,6.2 = 699,6 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,2.342}{699,6}.100\%\approx9,78\%\\C\%_{MgSO_4}=\dfrac{0,1.120}{699,6}.100\%\approx1,72\%\end{matrix}\right.\)

Bài 6 :
a) Pt : \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O|\)
1 1 1 1
a 2a 0,2
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O|\)
1 3 1 3
b 3b 0,1
b) Gọi a là số mol của MgO
b là số mol của Al2O3
\(m_{MgO}+m_{Al2O3}=18,2\left(g\right)\)
⇒ \(n_{MgO}.M_{MgO}+n_{Al2O3}.M_{Al2O3}=18,2g\)
⇒ 40a + 102b = 18,2g
Ta có : \(m_{ct}=\dfrac{19,6.250}{100}=49\left(g\right)\)
\(n_{H2SO4}=\dfrac{49}{98}=0,5\left(mol\right)\)
⇒ 1a + 3b = 0,5 (2)
Từ (1),(2), ta có hệ phương trình :
40a + 102b = 18,2g
1a + 3b = 0,5
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(m_{MgO}=0,2.40=8\left(g\right)\)
\(m_{Al2O3}=0,1.102=10,2\left(g\right)\)
d) Có : \(n_{MgO}=0,2\left(mol\right)\Rightarrow n_{MgSO4}=0,2\left(mol\right)\)
\(n_{Al2O3}=0,1\left(mol\right)\Rightarrow n_{Al2\left(SO4\right)3}=0,1\left(mol\right)\)
\(m_{MgSO4}=0,2.120=24\left(g\right)\)
\(m_{Al2\left(SO4\right)3}=0,1.342=34,2\left(g\right)\)
\(m_{ddspu}=18,2+250=268,2\left(g\right)\)
\(C_{MgSO4}=\dfrac{24.100}{268,2}=8,95\)0/0
\(C_{Al2\left(SO4\right)3}=\dfrac{34,2.100}{268,2}=12,75\)0/0
e) \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O|\)
2 1 1 2
1 0,5
\(n_{NaOH}=\dfrac{0,5.2}{1}=1\left(mol\right)\)
\(m_{NaOH}=1.40=40\left(g\right)\)
\(m_{ddnaOH}=\dfrac{40.100}{12}=333,33\left(g\right)\)
\(V_{ddNaOH}=\dfrac{333,33}{1,1}=303,2\left(ml\right)\)
Chúc bạn học tốt

a) B là \(Al_2\left(SO_4\right)_3\), C là \(Cu\)
\(b)n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 0,1 0,3
\(m_{hh}=0,2.27+3,2=8,6g\\ \%m_{Cu}=\dfrac{3,2}{8,6}\cdot100=37,21\%\\ \%m_{Al}=100-37,21=62,79\%\\ c)C_{M_{H_2SO_4}}=\dfrac{0,3}{0,25}=1,2M\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
nH2=4,48/22,4=0,2(mol)
=>nFe=0,2(mol)=>mFe=0,2.56=11,2(g)
=>mFeO=18,4-11,2=7,2(g)
b)nH2SO4=nH2=0,2(mol)
=>mH2SO4 7%=0,2.98=19,6(g)
=>mH2SO4 =19,6:7%=280(g)
c)mFeSO4=0,2.152=30,4(g)
mdd sau pư=18,4+280-0,2.2=298(g)
=>C%FeSO4=\(\frac{30,4}{298}.100\%\)=10,2%
1