Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Trích mẫu thử :
Cho quỳ tím lần lượt vào các dd :
- Hóa đỏ : HCl , HNO3 (1)
- Hóa xanh : NaOH
- Không HT : CaCl2 , NaNO3 (2)
Cho dd AgNO3 vào (1) :
- Kết tủa trắng : HCl
- Không ht : HNO3
Cho dd Na2CO3 vào (2) :
- Kết tủa trắng : CaCl2
- Không ht : NaNO3
AgNO3 + HCl => AgCl + HNO3
CaCl2 + Na2CO3 => CaCO3 + 2NaCl
b)
Trích mẫu thử :
Cho quỳ tím lần lượt vào từng mẫu thử :
- Hóa xanh : KOH , Ba(OH)2 (1)
- Hóa đỏ : HCl , HNO3 (2)
- Không HT : NaCl , NaNO3 (3)
Sục CO2 vào dung dịch (1) :
- Kết tủa trắng : Ba(OH)2
- Kết tủa trắng : KOH
Cho dd AgNO3 vào (2)
- Kết tủa trắng : HCl
- Không hiện tượng : HNO3
Cho dung dịch AgNO3 vào (3)
- Kết tủa trắng : NaCl
- Không hiện tượng : NaNO3

bài 1
câu a:
Mn02 + 4HCl --> MnCl2 + Cl2 + 2H20
Cl2 + H2 -->t° ánh sáng 2HCl
4HCl + Mn02 --> MnCl2 + Cl2 + 2H20
Cl2 + 2Na -->t° 2NaCl
2NaCl -->điện phân nóng chảy 2Na + Cl2
câu b/
2KMnO4 + 16HCl (đ) -> 2KCl + 2MnCl2 + 5Cl2 + 8H2O (Đ.C Cl2)
Cl2 + KOH -> KCl + KClO3 + H2O
2KClO3 -> 2KCl + 3O2 (đ/c khí O2 lớp 8)
2KCl -> 2K + Cl2
Cl2 + H2O ->HCl + HClO
2HCl + Fe -> FeCl2 + H2
2FeCl2 + Cl2 -> 2FeCl3
FeCl3 + NaOH -> Fe(OH)3 + NaCl
câu c/
HCl ---> Cl2 ---> FeCl3 ---> NaCl ---> HCl ---> CuCl2 ---> AgCl
2HCl→Cl2+H2
3Cl2+2Fe→2FeCl3
3NaOH+FeCl3→3NaCl+Fe(OH)3
H2SO4+NaCl→HCl+NaHSO4
CuO+2HCl→2H2O+CuCl2
2AgNO3+CuCl2→2AgCl+Cu(NO3)2
Bài 2:
CTHH: MO
\(n_{MO}=\dfrac{15,3}{M_M+16}\left(mol\right)\)
PTHH: MO + 2HCl --> MCl2 + H2O
=> \(n_{MCl_2}=\dfrac{15,3}{M_M+16}\left(mol\right)\)
=> \(\dfrac{15,3}{M_M+16}\left(M_M+71\right)=20,8\)
=> MM = 137 (g/mol)
=> M là Ba (Bari)
\(n_{BaO}=\dfrac{15,3}{153}=0,1\left(mol\right)\)
PTHH: BaO + 2HCl --> BaCl2 + H2O
0,1-->0,2
=> mHCl = 0,2.36,5 = 7,3 (g)
=> \(m_{ddHCl}=\dfrac{7,3.100}{18,25}=40\left(g\right)\)

Mình làm câu 2 nhé:
Cho thử quỳ tím:
- Quỳ tím chuyển đỏ -> H2SO4, HCl (1)
- Quỳ tím chuyển xanh -> NaOH
- Quỳ tím không đổi màu -> NaCl, NaI, NaBr (2)
Cho lần lượt các chất (1) tác dụng với BaCl2:
- Xuất hiện kết tủa trắng -> H2SO4
BaCl2 + H2SO4 -> BaSO4 + 2HCl
- Không hiện tượng -> HCl
Cho lần lượt các chất (2) tác dụng với AgNO3:
- Kết tủa màu trắng -> AgCl
NaCl + AgNO3 -> AgCl + NaNO3
- Kết tủa màu vàng nhạt -> NaBr
NaBr + AgNO3 -> NaNO3 + AgBr
Kết tủa màu vàng đậm -> NaI
NaI + AgNO3 -> AgI + NaNO3

a) Do sản phẩm thu được sau khi nung khi hòa tan vào dd HCl thu được hỗn hợp khí => Sản phẩm chứa Fe dư
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\); \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,05<-0,05-->0,05
Fe + 2HCl --> FeCl2 + H2
0,05-->0,1---------->0,05
FeS + 2HCl --> FeCl2 + H2S
0,05-->0,1------------->0,05
=> \(\%V_{H_2}=\%V_{H_2S}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
b)
nNaOH = 0,2.1 = 0,2 (mol)
PTHH: NaOH + HCl --> NaCl + H2O
0,2-->0,2
=> nHCl = 0,1 + 0,1 + 0,2 = 0,4 (mol)
=> \(C_{M\left(dd.HCl\right)}=\dfrac{0,4}{0,5}=0,8M\)

Câu 2: Chỉ dùng một thuốc thử nhận biết các chất đựng riêng biệt trong các lọ mất nhãn sau: NaCl, NaF, NaBr, NaI
cho AgNo3 vào từng mẫu thử
NaBr kết tủa vàng nhạt
NaI kết tủa vàng cam
NaCl kết tủa trắng
NaF không kết tủa
Câu 3: Viết phương trình hóa học chứng minh tính oxi hóa của Cl2 > Br2 > I2
a, Cl2 + NaBr → Br2 + NaCl và Br2 + NaI → I2 + NaBr
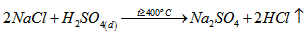
Câu 4: Giải thích tại sao: a, Khi điều chế khí hiđro clorua phải dùng muối NaCl tinh thể và axit H2SO4 đậm đặc b, Không dùng bình thủy tinh để đựng dung dịch HF
Phải dùngH2SO4đặc và muối ở trạng thái tinh thể để hiđro clorua tạo thành không hoà tan trong nước.
ko dùng bình thủy tinh để đựng dd HFvì HF có thể td với thủy tinh
bài 6
2Al+6HCl----.2AlCl3 +3H2(1)
x-------3x---------x------1,5x
Fe+2HCl----.>FeCl2+H2(2)
y------2y------------y------y
Ta có
nH2=8,96/22,4=0,4(mol)
Ta có hệ pt
{27x+56y=111,5
x+y=0,4⇒{x=0,2,y=0,1
%mAl=Al=0,2.27/11.100%=49,09%
%mFe=100−49,09=50,91%
b) Theo pthh
nHCl=2nH2=0,8(mol)
mHCl=0,8.36,5=29,2(g)
mdd=29,2.100/10=292(g)
câu 7
nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l

$a\bigg)$
$Cl_2+H_2O\leftrightharpoons HCl+HClO$
$CH_4+Cl_2\xrightarrow{ánh\, sáng}CH_3Cl+HCl$
$CH_3Cl+Cl_2\xrightarrow{ánh\, sáng}CH_2Cl_2+HCl$
$CH_2Cl_2+Cl_2\xrightarrow{ánh\, sáng}CHCl_3+HCl$
$CHCl_3+Cl_2\xrightarrow{ánh\, sáng}CCl_4+HCl$
$b\bigg)$
- Chất khử:
$2KMnO_4+16HCl\to 2KCl+2MnCl_2+5Cl_2+8H_2O$
- Chất oxi hóa:
$Fe+2HCl\to FeCl_2+H_2$
- Chất trao đổi:
$AgNO_3+HCl\to AgCl\downarrow+NaNO_3$

Câu 1:
a) \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(\dfrac{1}{2}Cl_2+K\underrightarrow{t^o}KCl\)
\(2KCl+2H_2O\xrightarrow[cómàngngăn]{đp}2KOH+Cl_2+H_2\)
\(Cl_2+H_2O⇌HCl+HClO\)
\(NaOH+HClO\rightarrow NaClO+H_2O\)
\(NaClO_{\left(rắn\right)}+HCl\rightarrow NaCl+Cl_2+H_2O\)
\(2NaCl+2H_2O\xrightarrow[cómàngngăn]{đp}2NaOH+Cl_2+H_2O\)
\(3Cl_2+2Fe\underrightarrow{t^o}2FeCl_3\)
b) \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(Cl_2+H_2\underrightarrow{a/s}2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
\(2FeCl_2+Cl_2\rightarrow2FeCl_3\)
\(FeCl_3+3KOH\rightarrow3KCl+Fe\left(OH\right)_3\downarrow\)
\(2KCl+2H_2O\xrightarrow[cmn]{đp}2KOH+Cl_2+H_2\)
\(6KOH+3Cl_2\underrightarrow{t^o}5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)

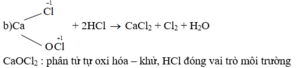

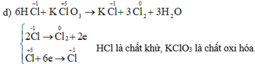
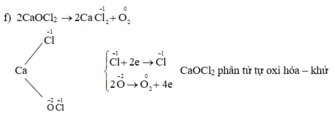
Bạn chia nhỏ câu hỏi ra ạ