Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MnO 2 + HCl → MnCl 2 + Cl 2 + 2 H 2 O
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
n MnO 2 = 0,2 mol; n NaOH = 0,729 mol
Theo phương trình (1) ta có: n Cl 2 = n MnO 2 = 0,2 mol
Theo phương trình (2) ta có: 2 n Cl 2 < n NaOH ⇒ NaOH dư
Dung dịch A gồm: n NaCl = n NaClO = n Cl 2 = 0,2 mol
n NaOH dư = 0,729 – 2.0,2 = 0,329 mol
m dd A = m Cl 2 + m dd NaOH = 0,2.71 + 145,8 = 160g
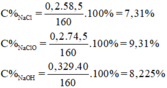

MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
nHCl = \(\dfrac{20.36,5\%}{36,5}\)= 0,2 mol => nCl2 = 0,2 : 4 = 0,05 mol
Cl2 + 2KOH →KCl + KClO + H2O
nKOH = 0,5.2 = 1 mol
=> KOH dư , Cl2 hết
nKOH dư = 1 - 0,05.2 = 0,9 mol
dung dịch A gồm KCl và KClO có số mol = nCl2 = 0,05 mol và KOH dư 0,9mol
CKCl = CKClO = \(\dfrac{0,05}{0,5}\)=0,1 M
CKOH dư = \(\dfrac{0,9}{0,5}\)= 1,8 M

Phản ứng xảy ra:
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có:
\(n_{MnO2}=\frac{13,05}{55+16.2}=0,15\left(mol\right)\)
\(\Rightarrow n_{Cl2}=n_{MnO2}=0,15\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}=0,5.1=0,5\left(mol\right)>2nCl_2\)
Nên NaOH dư.
\(\Rightarrow n_{NaCl}=n_{NaClO}=n_{Cl2}=0,15\left(mol\right)\)
\(n_{NaOH\left(Dư\right)}=0,5-0,15.2=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{NaCl}=\frac{0,15}{0,5}=0,3M\\CM_{NaClO}=\frac{0,15}{0,5}=0,3M\\CM_{NaOH\left(dư\right)}=\frac{0,2}{0,5}=0,4M\end{matrix}\right.\)

Chọn đáp án C
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
3 C l 2 + 6NaOH → t 0 5NaCl + N a C l O 3 + 3 H 2 O

\(FeS+2HCl\rightarrow FeCl_2+H_2S\)\(\uparrow\)
0.2 0.2
\(H_2S+4H_2O\rightarrow H_2SO_4+4H_2\)
0.2 0.2 0.8
a. \(n_{FeS}=\dfrac{17.6}{88}=0.2mol\)
\(mdd_{H_2SO_4}=m_X=m_{H_2S}+m_{H_2O}-m_{H_2}=0.2\times34+92.3-0.8\times2=97.5g\)
\(C\%_{H_2SO_4}=\dfrac{0.2\times98\times100}{97.5}=20,1\%\)
b. \(\dfrac{1}{2}dd_X\Rightarrow n_X=0.1mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0.2 0.1
\(mdd_{NaOH}=\dfrac{0.2\times40\times100}{20}=40g\)

\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

\(n_{KMnO_4} = \dfrac{15,8}{158} = 0,1(mol)\\ n_{HCl} = 0,08.2 = 0,16(mol)\)
2KMnO4 + 16HCl \(\to\) 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,02.............0,16...................................0,05..............(mol)
\(n_{NaOH} = 0,2.1,5 = 0,3(mol)\)
2NaOH + Cl2 \(\to\) NaCl + NaClO + H2O
0,1..........0,05......0,05......0,05........................(mol)
Vậy :
\(C_{M_{NaCl}} = C_{M_{NaClO}} = \dfrac{0,05}{0,2}= 0,25M\\ C_{M_{NaOH}} = \dfrac{0,3-0,1}{0,2} = 1M\)

35. Cho 15g MnO2 ( chứa 13% tạp chất trơ) tác dụng hết với dd HCl đặc dư , khí thoát ra đc hấp thụ hết vào 400ml dd NaOH 1M ở nhiệt độ thường. Tổng nồng độ mol /l của muối tạo thành?
----
mMnO2= (100%-13%).15=13,05(g)
=>nMnO2= 13,05/87=0,15(mol)
nNaOH= 1.0,4= 0,4(mol)
PTHH: MnO2 + 4 HCl(đ) -to-> MnCl2 + Cl2 + 2 H2O
0,15_________0,6_________0,15___0,15(mol)
Cl2 + 2 NaOH \(\leftrightarrow\) NaCl + NaClO + H2O
0,15_0,3_____0,15____0,15(mol)
Ta có: 0,4/2 > 0,15/1
=> Cl2 hết, NaOH dư, tính theo nCl2
Vddsau= VddNaOH= 0,4(l)
Tổng nồng độ mol dung dịch muối tạo thành:
\(C_{MddNaCl}+C_{MddNaClO}=\frac{0,15}{0,4}+\frac{0,15}{0,4}=0,75\left(M\right)\)
Câu 1:
a) \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(\dfrac{1}{2}Cl_2+K\underrightarrow{t^o}KCl\)
\(2KCl+2H_2O\xrightarrow[cómàngngăn]{đp}2KOH+Cl_2+H_2\)
\(Cl_2+H_2O⇌HCl+HClO\)
\(NaOH+HClO\rightarrow NaClO+H_2O\)
\(NaClO_{\left(rắn\right)}+HCl\rightarrow NaCl+Cl_2+H_2O\)
\(2NaCl+2H_2O\xrightarrow[cómàngngăn]{đp}2NaOH+Cl_2+H_2O\)
\(3Cl_2+2Fe\underrightarrow{t^o}2FeCl_3\)
b) \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(Cl_2+H_2\underrightarrow{a/s}2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
\(2FeCl_2+Cl_2\rightarrow2FeCl_3\)
\(FeCl_3+3KOH\rightarrow3KCl+Fe\left(OH\right)_3\downarrow\)
\(2KCl+2H_2O\xrightarrow[cmn]{đp}2KOH+Cl_2+H_2\)
\(6KOH+3Cl_2\underrightarrow{t^o}5KCl+KClO_3+3H_2O\)
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)