Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo ĐLBTKL: mAl2O3 = mAl + mO2
=> mAl2O3 = 10,8 + 9,6 = 20,4 (g)
=> \(\%Al_2O_3=\dfrac{20,4}{21,2}.100\%=96,226\%\)

a/ nAl= 54/27= 2(mol)
nO2=48/32=1,5(mol)
PTHH: 2 Al2O3 -to-> 4 Al +3 O2
Ta có: 2/4 = 1,5/3
=> P.ứ hết
=> nAl2O3= 1/2. nAl=1/2. 2=1(mol)
=> mAl2O3=1.102=102(g)
b) %mAl2O3= (102/127,5).100= 80%

Phương trình hóa học:
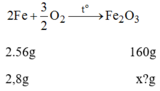
Khối lượng F e 2 O 3 ứng với lượng sắt trên là:
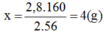
→ Chọn C.

a) PTHH: 4Al + 3O2 =(nhiệt)=> 2Al2O3
nAl = \(\frac{5,4}{27}=0,2\left(mol\right)\)
b) nO2 = \(\frac{0,2\times3}{4}=0,15\left(mol\right)\)
=> VO2(đktc) = 0,15 x 22,4 = 3,36 lít
c) nAl2O3 = \(\frac{0,2\times2}{4}=0,1\left(mol\right)\)
=> mAl2O3 = 0,1 x 102 = 10,2 gam

nFe=m/M=2,8/56=0,05(mol)
pt: 4Fe + 3O2 --t0-> 2Fe2O3
cứ: 4..........3...............2 (mol)
vậy: 0,05---------------->0,025(mol)
=> mFe2O3=n.M=0,025.160=4(g

1 mol sắt 3 oxit năng 160g chứa 112g Fe
=>với 2,8g fe thì khối lượng oxit là 2,8*160/112

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,2 0,1 ( mol )
\(m_{Al_2O_3}=0,1.102=10,2g\)
\(Al_2O_3\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ \Rightarrow n_O=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{Al_2O_3}=0,2.27+0,3.16=10,2\left(g\right)\)
3/2 ở đâu ạ