Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(2CuFeS_2+\frac{13}{2}O_2\underrightarrow{^{to}}2CuO+Fe_2O_3+4SO_2\)
\(\)b, Câu b mình đổi thành "% khối lượng chất rắn và V khí" nha.
\(n_{O2}=0,075\left(mol\right)\)
\(\Rightarrow n_{SO2}=\frac{3}{65}\left(mol\right)\)
\(\Rightarrow V_{SO2}=1,034\left(l\right)\)
\(n_{CuO}=\frac{3}{130}\left(mol\right)\Rightarrow m_{CuO}=1,85\left(g\right)\)
\(n_{Fe2O3}=\frac{3}{260}\left(mol\right)\Rightarrow m_{Fe2O3}=1,85\left(g\right)\)
\(\Rightarrow\%m_{CuO}=\%m_{Fe2O3}=50\%\)

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

\(1,2H_2+O_2\underrightarrow{t}2H_2O\)
\(2Mg+O_2\underrightarrow{t}2MgO\)
\(2Cu+O_2\underrightarrow{t}2CuO\)
\(S+O_2\underrightarrow{t}SO_2\)
\(4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(C+O_2\underrightarrow{t}CO_2\)
\(4P+5O_2\underrightarrow{t}2P_2O_5\)
\(2,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(a,n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(b,n_C=0,3\left(mol\right)\Rightarrow n_{CO_2}=0,3\left(mol\right)\Rightarrow m_{CO_2}=13,2\left(g\right)\)
c, Vì\(\frac{0,3}{1}>\frac{0,2}{1}\)nên C phản ửng dư, O2 phản ứng hết, Bài toán tính theo O2
\(n_{O_2}=0,2\left(mol\right)\Rightarrow n_{CO_2}=0,2\left(mol\right)\Rightarrow m_{CO_2}=8,8\left(g\right)\)
\(3,PTHH:CH_4+2O_2\underrightarrow{t}CO_2+2H_2O\)
\(C_2H_2+\frac{5}{2}O_2\underrightarrow{t}2CO_2+H_2O\)
\(C_2H_6O+3O_2\underrightarrow{t}2CO_2+3H_2O\)
\(4,a,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_P=1,5\left(mol\right)\Rightarrow n_{O_2}=1,2\left(mol\right)\Rightarrow m_{O_2}=38,4\left(g\right)\)
\(b,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_C=2,5\left(mol\right)\Rightarrow n_{O_2}=2,5\left(mol\right)\Rightarrow m_{O_2}=80\left(g\right)\)
\(c,PTHH:4Al+3O_2\underrightarrow{t}2Al_2O_3\)
\(n_{Al}=2,5\left(mol\right)\Rightarrow n_{O_2}=1,875\left(mol\right)\Rightarrow m_{O_2}=60\left(g\right)\)
\(d,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(TH_1:\left(đktc\right)n_{H_2}=1,5\left(mol\right)\Rightarrow n_{O_2}=0,75\left(mol\right)\Rightarrow m_{O_2}=24\left(g\right)\)
\(TH_2:\left(đkt\right)n_{H_2}=1,4\left(mol\right)\Rightarrow n_{O_2}=0,7\left(mol\right)\Rightarrow m_{O_2}=22,4\left(g\right)\)
\(5,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=0,46875\left(mol\right)\)
\(n_{SO_2}=0,3\left(mol\right)\)
Vì\(0,46875>0,3\left(n_{O_2}>n_{SO_2}\right)\)nên S phản ứng hết, bài toán tính theo S.
\(a,\Rightarrow n_S=n_{SO_2}=0,3\left(mol\right)\Rightarrow m_S=9,6\left(g\right)\)
\(n_{O_2}\left(dư\right)=0,16875\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=5,4\left(g\right)\)
\(6,a,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_C=1,5\left(mol\right)\Rightarrow m_C=18\left(g\right)\)
\(b,PTHH:2H_2+O_2\underrightarrow{t}2H_2O\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_{H_2}=0,75\left(mol\right)\Rightarrow m_{H_2}=1,5\left(g\right)\)
\(c,PTHH:S+O_2\underrightarrow{t}SO_2\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_S=1,5\left(mol\right)\Rightarrow m_S=48\left(g\right)\)
\(d,PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
\(n_{O_2}=1,5\left(mol\right)\Rightarrow n_P=1,2\left(mol\right)\Rightarrow m_P=37,2\left(g\right)\)
\(7,n_{O_2}=5\left(mol\right)\Rightarrow V_{O_2}=112\left(l\right)\left(đktc\right)\);\(V_{O_2}=120\left(l\right)\left(đkt\right)\)
\(8,PTHH:C+O_2\underrightarrow{t}CO_2\)
\(m_C=0,96\left(kg\right)\Rightarrow n_C=0,08\left(kmol\right)=80\left(mol\right)\Rightarrow n_{O_2}=80\left(mol\right)\Rightarrow V_{O_2}=1792\left(l\right)\)
\(9,n_p=0,2\left(mol\right);n_{O_2}=0,3\left(mol\right)\)
\(PTHH:4P+5O_2\underrightarrow{t}2P_2O_5\)
Vì\(\frac{0,2}{4}< \frac{0,3}{5}\)nên P hết O2 dư, bài toán tính theo P.
\(a,n_{O_2}\left(dư\right)=0,05\left(mol\right)\Rightarrow m_{O_2}\left(dư\right)=1,6\left(g\right)\)
\(b,n_{P_2O_5}=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=14,2\left(g\right)\)

\(a)\\ 2CO + O_2 \xrightarrow{t^o} 2CO\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{H_2} = n_{H_2O} = \dfrac{1,8}{18} = 0,1(mol)\\ \)
Theo PTHH :
\(2n_{O_2} = n_{CO} + n_{H_2}\\ \Leftrightarrow 2.\dfrac{3,36}{22,4} = n_{CO} + 0,1\\ \Leftrightarrow n_{CO} = 0,2(mol)\\ \%V_{H_2} = \dfrac{0,1}{0,1+ 0,2}.100\% = 33,33\%\\ \%V_{CO} = 100\%-33,33\% = 66,67\%\\ c) Cách\ 1 :\\ n_{CO_2} = n_{CO} = 0,2(mol)\\ m_{CO_2} = 0,2.44 = 8,8(gam)\\ Cách\ 2 : \\ m_{hh} = m_{CO} + m_{H_2} = 0,2.28 + 0,1.2 = 5,8(gam) \)
Bảo toàn khối lượng :
\(m_{hh} + m_{O_2} = m_{H_2O} + m_{CO_2}\\ \Rightarrow m_{CO_2} = 5,8 + 0,15.32 - 1,8 = 8,8(gam)\)

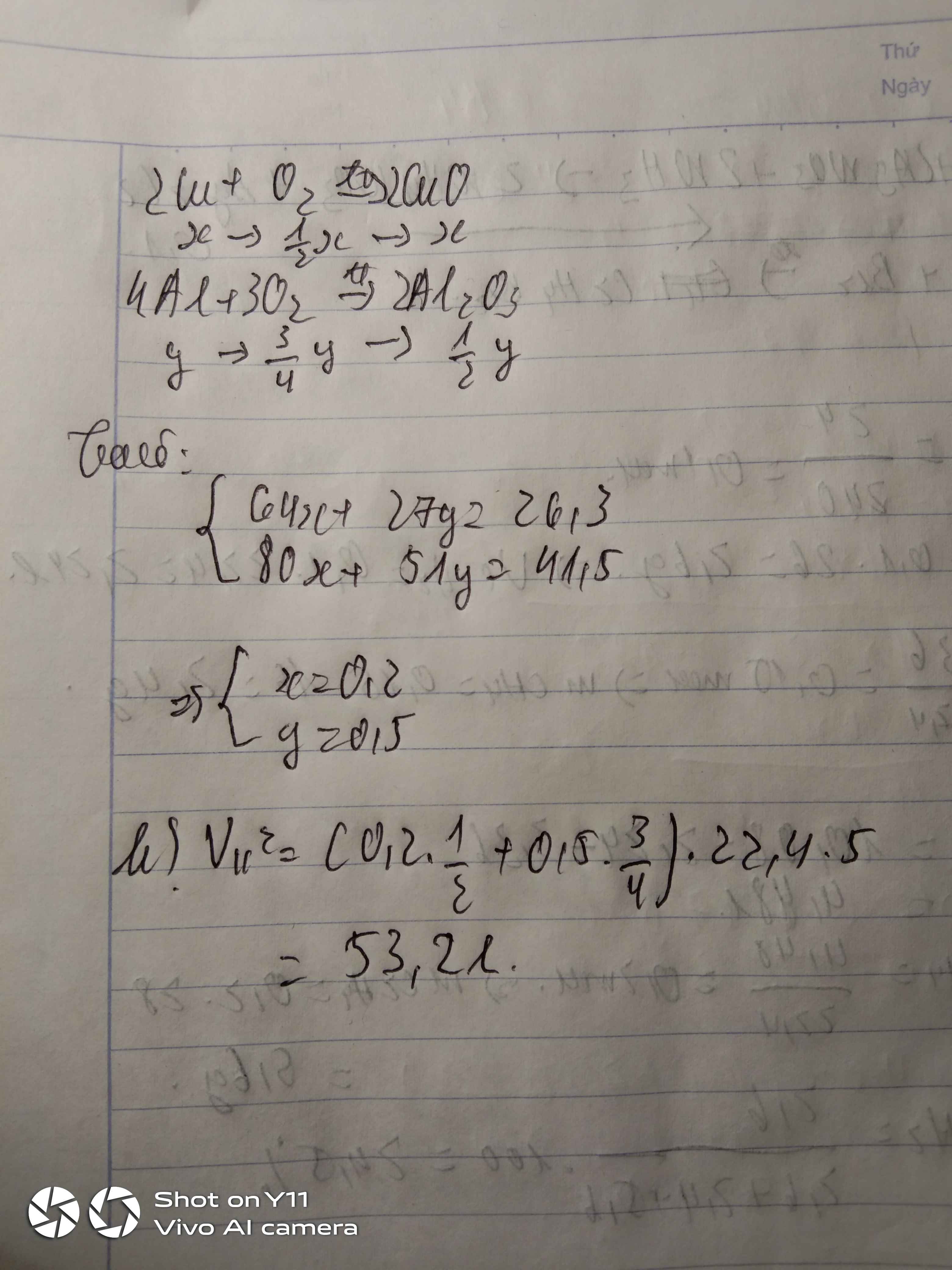
Bài 1:
a) 2CuFeS2 + \(\dfrac{13}{2}\)O2 --to--> 2CuO + Fe2O3 + 4SO2
b) \(n_{CuFeS_2}=\dfrac{3,68}{184}=0,02\left(mol\right)\)
\(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,02}{2}< \dfrac{0,075}{\dfrac{13}{2}}\) => CuFeS2 hết, O2 dư
PTHH: 2CuFeS2 + \(\dfrac{13}{2}\)O2 --to--> 2CuO + Fe2O3 + 4SO2
0,02----->0,065------->0,02---->0,01---->0,04
=> \(\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=0,075-0,065=0,01\left(mol\right)\\n_{SO_2}=0,04\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{0,01}{0,01+0,04}.100\%=20\%\\\%V_{SO_2}=\dfrac{0,04}{0,01+0,04}.100\%=80\%\end{matrix}\right.\)
- \(\left\{{}\begin{matrix}m_{CuO}=0,02.80=1,6\left(g\right)\\m_{Fe_2O_3}=0,01.160=1,6\left(g\right)\end{matrix}\right.\)
=> mrắn = 1,6 + 1,6 = 3,2 (g)
Bài 2:
a)
2CuS + 3O2 --to--> 2CuO + 2SO2
4FeS + 7O2 --to--> 2Fe2O3 + 4SO2
b) Gọi số mol CuS, FeS là a, b (mol)
=> 96a + 88b = 22,8 (1)
\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> a + b = 0,25 (2)
(1)(2) => a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}n_{CuO}=0,1\left(mol\right)\\n_{Fe_2O_3}=0,075\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1.80}{0,1.80+0,075.160}.100\%=40\%\\\%m_{Fe_2O_3}=\dfrac{0,075.160}{0,1.80+0,075.160}.100\%=60\%\end{matrix}\right.\)