
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


B4:
\(CTTQ:Na_xS_yO_z\left(x,y,z:nguy\text{ê}n,d\text{ươ}ng\right)\\ n_{Na}=\dfrac{4.6}{23}=0,2\left(mol\right);n_S=\dfrac{3,2}{32}=0,1\left(mol\right);n_O=\dfrac{4,8}{16}=0,3\left(mol\right)\\ x:y:z=0,2:0,1:0,3=2:1:3\\ \Rightarrow x=2;y=1;z=3\\ \Rightarrow CTHH:Na_2SO_3\)

Chào các bạn mình mới vô có ai có thể kết bạn với tôi ko?
TL
Hi bn 🤗
HT


Công thức tính số mol (n; đơn vị: mol)
Công thức tính tỉ khối của chất khí.
Công thức tính khối lượng chất tan (m hoặc m ct ; đơn vị: gam)
Công thức tính thể tích chất khí (V khí hoặc V; đơn vị: lít)
Công thức tính thành phần phần trăm về khối lượng các chất trong hỗn hợp.
Công thức tính thành phần phần trăm về thể tích các chất trong hỗn hợp.
Công thức tính hiệu suất phản ứng
Công thức tính khối lượng chất tham gia khi có hiệu suất.
Công thức tính khối lượng sản phẩm khi có hiệu suất.

Bài 5
\(n_{Al_2O_3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: Al2O3 + 6HCl --> 2AlCl3 + 3H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,5}{6}\) => Al dư, HCl hết
PTHH: Al2O3 + 6HCl --> 2AlCl3 + 3H2O
\(\dfrac{1}{12}\)<----0,5------->\(\dfrac{1}{6}\)----->0,25
=> \(\left\{{}\begin{matrix}m_{Al\left(dư\right)}=10,2-\dfrac{1}{12}.102=1,7\left(g\right)\\m_{AlCl_3}=\dfrac{1}{6}.133,5=22,25\left(g\right)\\m_{H_2}=0,25.18=4,5\left(g\right)\end{matrix}\right.\)
Bài 6
a) \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,1<-------------0,1<----0,1
=> \(n_{Mg\left(pư\right)}=0,1\left(mol\right)< 0,2\)
=> Mg dư => HCl hết
b) \(m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
\(m_{Mg\left(dư\right)}=\left(0,2-0,1\right).24=2,4\left(g\right)\)

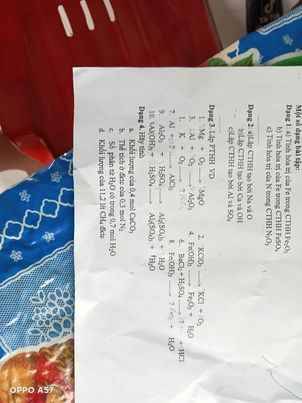
\(a.4FeS_2+11O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+8SO_2\)
\(b.2Fe\left(OH\right)_3\underrightarrow{^{^{t^0}}}Fe_2O_3+3H_2O\)
\(c.SO_2+2H_2S\underrightarrow{^{^{t^0}}}3S+2H_2O\)
\(d.\) Câu này em xem lại sản phẩm giúp anh nhé. Có thể là 1 trong 2 phương trình dưới đây.
\(4Fe\left(OH\right)_2+O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+4H_2O\)
\(4Fe\left(OH\right)_2+O_2+2H_2O\rightarrow4Fe\left(OH\right)_3\)
\(e.Cl_2+SO_2+2H_2O\rightarrow H_2SO_4+2HCl\)
\(f.Ca\left(OH\right)_2+NH_4NO_3\rightarrow Ca\left(NO_3\right)_2+NH_3+H_2O\)
\(g.2KHCO_3+Ca\left(OH\right)_2\rightarrow K_2CO_3+CaCO_3+2H_2O\)
\(h.2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{^{^{t^0}}}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(i.MnO_2+4HCl_{\left(đ\right)}\rightarrow MnCl_2+Cl_2+2H_2O\)
 Ai chỉ tôi với
Ai chỉ tôi với



bài 1:
theo định luật bảo toàn khối lượng,
=> 65 + 36,5= ZnCl2 + 2
=> khối lượng ZnCl2 tạo thành = 99,6g
bài 2:
theo định luật bảo toàn khối lượng,
=> Mg +6 = 15
=> khối lượng Mg cần dùng để đốt cháy = 9g