
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

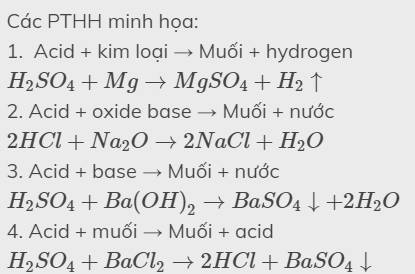

Các PTHH minh họa:
1. Acid + kim loại → Muối + hydrogen
\(H_2SO_4+Mg\rightarrow MgSO_4+H_2\uparrow\)
2. Acid + oxide base → Muối + nước
\(2HCl+Na_2O\rightarrow2NaCl+H_2O\)
3. Acid + base → Muối + nước
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
4. Acid + muối → Muối + acid
\(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4\downarrow\)

\(n_{H_2}=\dfrac{7,436}{24,79}=0,3\left(mol\right)\)
PTHH :
\(2Al+6HCL\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 0,6 0,2 0,3
\(b,C_{M\left(HCl\right)}=\dfrac{0,6}{0,2}=3\left(M\right)\)
\(c,m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)

a) \(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,15-->0,3------>0,15-->0,15
=> mHCl = 0,3.36,5 = 10,95 (g)
b)
mZnCl2 = 0,15.136 = 20,4 (g)
c)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,05<---0,15------->0,1
=> mFe2O3 = 0,05.160 = 8 (g)
mFe = 0,1.56 = 5,6 (g)
a.b.\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{9,75}{65}=0,15mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,15 0,3 0,15 0,15 ( mol )
\(m_{HCl}=n_{HCl}.M_{HCl}=0,3.36,5=10,95g\)
\(m_{ZnCl_2}=n_{ZnCl_2}.M_{ZnCl_2}=0,15.136-20,4g\)
c.\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,05 0,15 0,1 ( mol )
\(m_{Fe_2O_3}=n_{Fe_2O_3}.M_{Fe_2O_3}=0,05.160=8g\)
\(m_{Fe}=n_{Fe}.M_{Fe}=0,1.56=5,6g\)

\(n_{Zn}=\dfrac{13}{65}=0,2(mol)\\ a,Zn+2HCl\to ZnCl_2+H_2\\ \Rightarrow n_{H_2}=0,2(mol);n_{HCl}=0,4(mol)\\ b,m_{HCl}=0,4.36,5=14,6(g)\\ c,V_{H_2}=0,2.24,79=4,958(l)\)

a) Mg + 2HCl --> MgCl2 + H2
b) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2--->0,4-------------->0,2
=> mHCl = 0,4.36,5 = 14,6 (g)
c) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
d)
PTHH: CuO + H2 --to--> Cu + H2O
0,2------->0,2
=> mCu = 0,2.64 = 12,8 (g)

Đề sai:
Sửa lại:
Cho 2,7 gam aluminium tác dụng với acid sunfuric acid a a.Viết PTHH b.Tính khối lượng muối tạo thành c.Nếu dùng thể tích khí hydrogen sinh ra để khử 23,2 gam Fe3O4 tính khối lượng kim loại thu được
a, \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b, \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,05\left(mol\right)\)
\(\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,15\left(mol\right)\)
Ta có: \(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
PT: \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,15}{4}\), ta được Fe3O4 dư.
Theo PT: \(n_{Fe}=\dfrac{3}{4}n_{H_2}=0,1125\left(mol\right)\Rightarrow m_{Fe}=0,1125.56=6,3\left(g\right)\)

\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ b.n_{Mg}=\dfrac{4,8}{24}=0,2mol\\ Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=0,2.24,79=4,958l\\ c.m_{MgCl_2}=0,2.95=19g\\ d.C_{M_{HCl}}=\dfrac{0,4}{0,3}=\dfrac{4}{3}M\)