Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{HCl}=\dfrac{200}{1000}.2=0,4\left(mol\right)\)
\(PTHH:Mg+2HCl--->MgCl_2+H_2\uparrow\left(1\right)\)
a. Theo PT(1): \(n_{Mg}=n_{H_2}=n_{MgCl_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,2.24=4,8\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(lít\right)\end{matrix}\right.\)
b. \(PTHH:2NaOH+MgCl_2--->Mg\left(OH\right)_2\downarrow+2NaCl\left(2\right)\)
Ta có: \(n_{NaOH}=\dfrac{\dfrac{20\%.100}{100\%}}{40}=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,5}{2}>\dfrac{0,2}{1}\)
Vậy NaOH dư.
Theo PT(2): \(n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Mg\left(OH\right)_2}=0,2.58=11,6\left(g\right)\)
a: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
200ml=0,2 lít
\(n_{HCl}=0.2\cdot22.4=4.48\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{H_2}=n_{H_2}\cdot M=2.24\cdot1=2.24\left(g\right)\)
\(n_{MgCl_2}=2.24\left(mol\right)\)
\(\Leftrightarrow n_{Mg}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{Mg}=2.24\cdot24=53.76\left(g\right)\)

1) \(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
PTHH: \(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,03<----------------------0,01
=> nNaOH min = 0,03 (mol)
=> \(C_{M\left(NaOH\right)}=\dfrac{0,03}{0,2}=0,15M\)
2) \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,25=0,075\left(mol\right)\)
PTHH: \(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,45<------0,075-------------------------->0,15
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,05<----0,05
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1<-------0,05
=> nNaOH max = 0,5 (mol)
=> \(V_{dd}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
3)
\(n_{KOH\left(1\right)}=0,15.1,2=0,18\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(1\right)}=\dfrac{4,68}{78}=0,06\left(mol\right)\)
\(n_{AlCl_3}=0,1.x\left(mol\right)\)
Do khi cho KOH tác dụng với dd Y xuất hiện kết tủa
=> Trong Y chứa AlCl3 dư
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
0,18---->0,06----------------->0,06
\(n_{KOH\left(2\right)}=0,175.1,2=0,21\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(2\right)}=\dfrac{2,34}{78}=0,03\left(mol\right)\)
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
(0,3x-0,18)<--(0,1x-0,06)------->(0,1x-0,06)
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
(0,1x-0,09)<-(0,1x-0,09)
=> \(\left(0,3x-0,18\right)+\left(0,1x-0,09\right)=0,21\)
=> x = 1,2

\(\left\{{}\begin{matrix}n_{HCl}=0,1\left(mol\right)\\n_{AlCl3}=0,2\left(mol\right)\\n_{Al\left(OH\right)3}=0,1\left(mol\right)\end{matrix}\right.\)
Tạo kết tủa => HCl bị trung hoà hết
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(\Rightarrow n_{NaOH\left(trung.hoa\right)}=0,1\left(mol\right)\)
- TH1: dư AlCl3
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(\Rightarrow n_{NaOH}=0,3\left(mol\right)\)
\(\Rightarrow\Sigma n_{NaOH}=0,4\left(mol\right)\)
\(\Rightarrow V=0,4\left(l\right)=400\left(ml\right)\)
- TH2: dư NaOH
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
=> 0,2 mol AlCl3 tạo 0,2 mol Al(OH)3. Có 0,6 mol NaOH phản ứng
=> 0,2-0,1= 0,1 mol Al(OH)3 tan
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
\(\Rightarrow n_{NaOH}=0,1\left(mol\right)\)
\(\Rightarrow\Sigma n_{NaOH}=0,8\left(mol\right)\)
\(\Rightarrow V=0,8\left(l\right)=800\left(ml\right)\)

a, Vì Ag đứng ngay sau Cu trong dãy hoạt động
=> M phản ứng với cả 2 dd, phản ứng với dd Ag trước dd Cu sau
PTHH
\(M+3AgNO_3\) \(\rightarrow\)\(M\left(NO_3\right)_3+3Ag\) (1)
0,03 0,03 0,03 mol
\(2M+3Cu\left(NO_3\right)_2\)\(\rightarrow\)\(2M\left(NO_3\right)_3+3Cu\) (2)
\(n_{AgNO_3}=0,2.0,15=0,03\) mol
\(n_{Cu\left(NO_3\right)_2}=0,1.0,15=0,015\) mol
Theo pt (1) \(n_{Ag}=n_{AgNO_3}=0,03\) mol => \(n_{M\left(1\right)}=\dfrac{1}{3}n_{Ag}=0,01\) mol
=> \(m_{Ag}=0,03.108=3,24g\)
=>\(m_{Cu\left(pt2\right)}=3,72-3,24=0,48g\)
=> \(n_{Cu}=\dfrac{0,48}{64}=0,0075\) mol
=> \(n_{M\left(2\right)}=\dfrac{2}{3}n_{Cu}=0,005\) mol
=> \(n_M=0,005+0,01=0,015\) mol
=> \(M_M=\dfrac{m}{n}=\dfrac{0,405}{0,015}=27\) (g/mol)
=> M là Nhôm ( Al )

Tóm tắt:
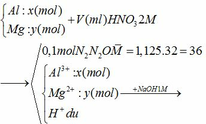
Gọi số mol của N2 và N2O lần lượt là
a và b (mol)
Ta có:
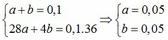


ne (KL nhường) = ne(N+5 nhận)
=> 2x + 3y = 0,5 + 0,4 (1)
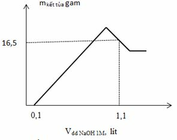
Từ đồ thị ta thấy tại giá trị V= 0,1 (lít) tức nNaOH = 0,1 (mol) mới bắt đầu xuất hiện kết tủa=> lượng NaOH này chính là lượng để trung hòa HNO3 dư sau phản ứng=> nHNO3 dư = nNaOH0,1 (mol) Ta thấy tại giá trị V= 1,1 (lít) tức nNaOH = 1,1 (lít) đồ thị đi lên cực đại sau đó lại đi xuống => kết tủa đạt cực đại sau đó bị hòa tan 1 phần ( chỉ có Al(OH)3 bị hoàn tan) Khi cho NaOH từ từ vào dung dich .Z xảy ra phản ứng:
H+ + OH- → H2O
0,1 → 0,1 (mol)
Mg2+ + 2OH- → Mg(OH)2↓
x → 2x (mol)
Al3+ + 3OH- → Al(OH)3↓
y → 3y →y (mol)
Al(OH)3↓ + OH- → AlO2- + 2H2O
(y – z ) → (y –z) (mol)
Gọi số mol của Al(OH)3 còn lại không bị hoàn tan là z (mol)
=> ta có: ∑ nNaOH = nH+dư + 2nMg2+ + 4nAl3+ - nAl(OH)3
=> 0,1 +2x + 4y – z = 1,1 (2)
Mặt khác: ∑ mkết tủa = mMg(OH)2 + mAl(OH)3 chưa hòa tan
=> 58x + 78z = 16,5 (3)
Từ (1), (2) và (3) => x = 0,2 ; y = 0,15 và z = 0,1 (mol)
=> m = mAl + mMg = 0,2.27 + 0,15.24 = 9 (g)
nHNO3 = nHNO3 dư + 2nN2 + 2nN2O + 3nAl(NO3)3 + 2nMg(NO3)2 = 0,1 + 2.0,05 + 2. 0,05 + 3.0,2 + 2.0,15 = 1,2 (mol)
=> VHNO3 = n : CM = 1,2 : 2 = 0,6 (lít) = 600 (ml)

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g