Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,n_{Fe_2O_3}=\dfrac{12,8}{160}=0,08\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,08---->0,24------>0,16
b, VH2 = 0,24.24,79 = 5,9496 (l)
c, mFe = 0,16.56 = 8,96 (g)
\(d,n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
LTL: \(0,16< \dfrac{0,4}{2}\) => HCl dư
Thep pthh: nH2 = nFe = 0,16 (mol)
=> VH2 = 0,16.24,79 = 3,9664 (l)
\(n_{Fe_2O_3}=\dfrac{12,8}{160}=0,08\left(mol\right)\\
pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,08 0,24 0,16
\(V_{H_2}=0,24.22,4=5,376l\\
m_{Fe}=0,16.56=8,96\left(mol\right)\)
\(n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\\
pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
\(LTL:\dfrac{0,16}{1}< \dfrac{0,4}{2}\)
=>HCl dư
\(n_{H_2}=n_{Fe}=0,16\left(mol\right)\\
V_{H_2}=0,16.22,4=3,584l\)

a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$Fe_2O_3 + 2Al \xrightarrow{t^o} 2Fe + Al_2O_3$
b) Phản ứng oxi hóa - khử
Chất khử : $CO,H_2,Al$
Chấy oxi hóa : $Fe_2O_3$
c)
$n_{CO} = n_{H_2} = 3n_{Fe_2O_3} = 0,45(mol)$
$V_{CO} = V_{H_2} = 0,45.22,4 = 10,08(lít)$
$n_{Al} = 2n_{Fe_2O_3} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
d)
Khối lượng sắt thu được ở phản ứng trên đều như nhau
(Do đều sinh ra Fe với tỉ lệ mol $Fe_2O_3$ : $Fe$ là 1 : 2)

Phản ứng oxi hoá – khử: đốt than trong lò, dùng cacbon oxit khử sắt(III) oxit trong luyện kim, sắt bị gỉ trong không khí.
Phản ứng a có lợi: sinh ra nhiệt để sản xuất, phục vụ đời sống; tác hại: tạo ra khí C O 2 làm ô nhiễm môi trường.
Phản ứng b có lợi: luyện quặng sắt thành sắt, điều chế sắt; tác hại: sinh ra khí C O 2 làm ô nhiễm môi trường.
Phản ứng d có hại: làm sắt bị gỉ dẫn đến hư hại các công trình xây dựng, các dụng cụ và đồ dùng bằng sắt.

Bạn ưi, bạn có thể ghi đúng đề ra đc ko? PƯHH phải gồm các chất tham gia, chất sản phẩm, phân biệt 2 chất này phải nhờ vào mũi tên, chứ đề ko thấy mũi tên đâu~
a, Phản ứng hóa hợp .
b, Phản ứng oxi hóa - khử .
c, Phản ứng phân hủy .
d, Phản ứng phân hủy .
e, Phản ứng cháy ( tỏa nhiệt )

Phương trình hóa học biểu diễn các phản ứng:
2H2 + O2 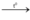 2H2O (pứ hóa hợp + oxi hóa khử)
2H2O (pứ hóa hợp + oxi hóa khử)
4H2 + Fe3O4 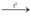 4H2O + 3Fe (pứ thế + oxi hóa khử)
4H2O + 3Fe (pứ thế + oxi hóa khử)
3H2 + Fe2O3 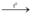 3H2O + 3Fe (pứ thế + oxi hóa khử)
3H2O + 3Fe (pứ thế + oxi hóa khử)
H2 + PbO 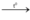 H2O + Pb (pứ thế + oxi hóa khử)
H2O + Pb (pứ thế + oxi hóa khử)
Các phản ứng trên đều là phản ứng oxi – hóa khử vì đều có đồng thời sự khử và sự oxi hóa

\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\\ Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\\ Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\\ PbO+H_2\xrightarrow[]{t^o}Pb+H_2O\)

2H2 + O2 -to-> H2O (1)
Fe2O3 + H2 -.to-> 2Fe + 3CO2 (2)
Fe3O4 + 4H2-to-> 3Fe +4H2O (3)
PbO + H2 -to-> Pb + H2O (4)
Các phản ứng trên đều là phản ứng oxi hóa khử
Trong đó, H2 là chất khử vì là chất chiếm oxi của chất khác và O2, Fe3O4, Fe2O3, PbO đều là chất oxi hóa vì là chất nhường oxi cho H2 (phản ứng (1) còn được gọi là phản ứng hóa hợp)
