Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích khí H2: 

 Số mol
Số mol
Phương trình:
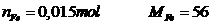


 khối lượng
khối lượng
Vậy m = 0,84gam

Câu 1:
a) - Điều chế O2:
.........2KClO3 --to--> 2KCl + 3O2
- Điều chế ZnO:
..........2Zn + O2 --to--> 2ZnO
- Điều chế H2, FeSO4:
..........Fe + H2SO4 (loãng) --> FeSO4 + H2
b) Pt: 2KClO3 --to--> 2KCl + 3O2
- Điều chế Al2O3:
..........4Al + 3O2 --to--> 2Al2O3
- Điều chế SO2:
...........S + O2 --to--> SO2
- Điều chế Fe3O4:
...........3Fe + 2O2 --to--> Fe3O4
c) - Điều chế H2:
............Zn + H2SO4 (loãng) --> ZnSO4 + H2
- Điều chế O2:
...........2KMnO4 --to--> K2MnO4 + MnO2 + O2
- Điều chế H2O:
...........2H2 + O2 --to--> 2H2O
- Điều chế H3PO4:
...........4P + 5O2 --to--> 2P2O5
...........P2O5 + 3H2O --> 2H3PO4
Câu 2:
nAlCl3 = \(\dfrac{26,7}{133,5}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + ....3H2
0,2 mol<----------- 0,2 mol-> 0,3 mol
mAl pứ = 0,2 . 27 = 5,4 (g)
VH2 = 0,3 . 22,4 = 6,72 (lít)
nH2O = \(\dfrac{9}{18}=0,5\) mol
Pt: .....2H2 + O2 --to--> 2H2O
...0,3 mol-------------> 0,3 mol
...CH4 + 2O2 --to--> CO2 + 2H2O
0,1 mol<--------------------(0,5 - 0,3) mol
VCH4 cần dùng = 0,1 . 22,4 = 2,24 (lít)

Bạn nên thêm ↑ vào sau chỗ \(H_2\) nhé
Cho Mg và Cu vào HCl thì chỉ có Mg pứ (Cu ko Pứ vì Cu đứng sau H trong dãy điện hóa)
 Thể tích khí H2:
Thể tích khí H2: 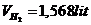
 |
 Số mol
Số mol
Phương trình :



 khối lượng
khối lượng
Vậy khối lượng Mg : 
Vậy khối lượng Cu: 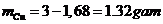
nH2=\(\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
Mg+2HCl\(\rightarrow\)MgCl2+H2
0,07.........................0,07(mol)
Cu+HCl không pứ
\(\Rightarrow\)mMg=0,07.24=1,68(g)
\(\Rightarrow\)mCu=3-1,68=1,32(g)
Chúc bạn học tốt!

3Fe + 2O2 \(\underrightarrow{t^0}\) Fe3O4
Áp dụng ĐLBTKL, ta có
mFe + mO2 = mFe3O4
16,8 + mO2 = 23,2
mO2 = 6,4 (g)
nFe\(_3\)O\(_4\)=0,1 mol
nFe=0,3 mol
3Fe + 2O2 →Fe3O4
0,3 0,2 0,1
\(\Rightarrow\)mO2\(=0,2\times32=6,4\) g

Ta có : \(n_C=0,4\left(mol\right),n_{O2}=0,3\left(mol\right)\)
PTHH: \(C+O_2\rightarrow CO_2\)
Vì: \(\frac{n_C}{1}=0,4;\frac{n_{O2}}{2}=0,3\)
Nên Cacbon dư
\(\rightarrow V_{CO2}=22,4=0,3=6,72\left(l\right)\)
\(\rightarrow m_{C_{du}}=0,1.12=1,2\left(g\right)\)

\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: 2..........6...............2...............3
Theo đề: 0,1.......0,3...........0,1.........0,15
a. Số gam axit cần dùng là:
\(m_{HCl}=n.M=0,3.36,5=10,95\left(g\right)\)
b. Số gam nhôm tham gia phản ứng là:
\(m_{Al}=0,1.27=2,7\left(g\right)\)
c. Số gam nhôm clorua thu được là:
\(n_{AlCl_3}=\dfrac{0,15.2}{3}=0,1\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\)
( \(AlCl_3\) là nhôm clorua)

Câu 1 :
mAl = \(7,5\times\dfrac{36}{100}=2,7\left(g\right)\)
=> nAl = \(\dfrac{2,7}{27}=0,1\) mol
mMg = mhh - mAl = 7,5 - 2,7 = 4,8 (g)
=> nMg = \(\dfrac{4,8}{24}=0,2\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1 mol------------> 0,1 mol-> 0,15 mol
.....Mg + 2HCl --> MgCl2 + H2
0,2 mol-----------> 0,2 mol-> 0,2 mol
mhh muối = mAlCl3 + mMgCl2 = (0,1 . 133,5) + (0,2 . 95) = 32,35 (g)
VH2 thu được = (0,15 + 0,2) . 22,4 = 7,84 (lít)
Câu 3 :
nZn = \(\dfrac{13}{65}=0,2\) mol
nHCl = \(\dfrac{21,9}{36,5}=0,6\) mol
Pt: Zn + 2HCl --> ZnCl2 + H2
0,2 mol-> 0,4 mol--------> 0,2 mol
Xét tỉ lệ mol giữa Zn và HCl:
\(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
Vậy HCl dư
mHCl dư = (0,6 - 0,4) . 36,5 = 7,3 (g)
VH2 thu được = 0,2 . 22,4 = 4,48 (lít)
Sau khi pứ kết thúc cho giấy quỳ tím vào quỳ tím chuyển sang màu đỏ vì HCl dư


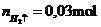
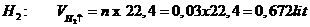


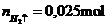

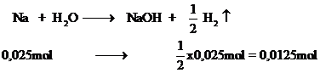
Bạn nên thêm ↑ vào sau \(H_2\) nhé
Giải:
Phương trình:
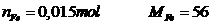


Vậy m = 0,84gam