Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2--------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => H2 hết, CuO dư
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2-------->0,2
=> mrắn sau pư = 24 - 0,2.80 + 0,2.64 = 20,8 (g)
c)
PTHH: RO + H2 --to--> R + H2O
0,2------>0,2
=> \(M_R=\dfrac{12,8}{0,2}=64\left(g/mol\right)\)
=> R là Cu
+) \(N_{Mg}\) = \(\dfrac{m}{M}\) = \(\dfrac{4,8}{24}\) = 0,2 mol
a) Mg + HCl -> \(MgCl_2\) + \(H_2\)
0,2 -> 0,2 (mol)
b) +) \(N_{CuO}\text{ }\)= \(\dfrac{m}{M}\) = \(\dfrac{24}{80}\) = 0,3 mol
+) \(H_2\) + CuO -> Cu + \(H_2O\)
+) Ta có: \(\dfrac{N_{H_2}}{1}\)= \(\dfrac{0,2}{1}\) < \(\dfrac{N_{CuO}}{1}\)= \(\dfrac{0,3}{1}\)
=> \(H_2\) hết. Tính toán theo \(N_{H_2}\)
+)\(H_2\) + CuO -> Cu + \(H_2O\)
Ban đầu: 0,2 0,3 0 0 }
P/ứng: 0,2 -> 0,2 -> 0,2 -> 0,2 } mol
Sau p/ư: 0 0,1 0,2 0,2 }
=> \(m_{Cu}\) = 12,8 gam .Thu được 2,8 gam Cu

\(n_{HCl}=0.2\cdot1=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(........0.2..............0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.1.......0.1....0.1\)
\(\Rightarrow CuOdư\)
\(m_{Cu}=0.1\cdot64=6.4\left(g\right)\)

a) \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,25----------------->0,25
=> VH2 = 0,25.22,4 = 5,6 (l)
b)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\) => CuO hết, H2 dư
PTHH: CuO + H2 --to--> Cu + H2O
0,2-------------->0,2
=> mCu = 0,2.64 = 12,8 (g)

a) \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,25-------------------->0,25
=> VH2 = 0,25.22,4 = 5,6 (l)
b)
PTHH: CuO + H2 --to--> Cu + H2O
0,25--->0,25
=> mCu = 0,25.64 = 16 (g)

nFe = 16,8/56 = 0,3 (mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
Mol: 0,3 ---> 0,6 ---> 0,3 ---> 0,3
VH2 = 0,3 . 24,79 = 7,437 (l)
mHCl = 0,6 . 36,5 = 21,9 (g)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,3 <--- 0,3 ---> 0,3
mCu = 0,3 . 64 = 19,2 (g)
mFe = 16,8: 56 =0,3(mol)
pthh : Fe + 2HCl --> FeCl2 + H2 (1)
0,3 ->0,6-----------------> 0,3 (mol)
=> VH2 (đkc) = 0,3 . 24,79 ( l)
=> mHCl = 0,6 . 35,5 = 21,9 (g)
pthh : CuO + H2 -t--> Cu+ H2O
0,3<-----0,3 (mol)
=>mCu = 0,3 . 64 = 19,2 (g)

Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+2HCl--->FeCl_2+H_2\left(1\right)\)
\(CuO+H_2\overset{t^o}{--->}Cu+H_2O\left(2\right)\)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15.22,4=3,36\left(lít\right)\)
b. Ta thấy: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\)
Vậy CuO dư.
Theo PT(2): \(n_{Cu}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)
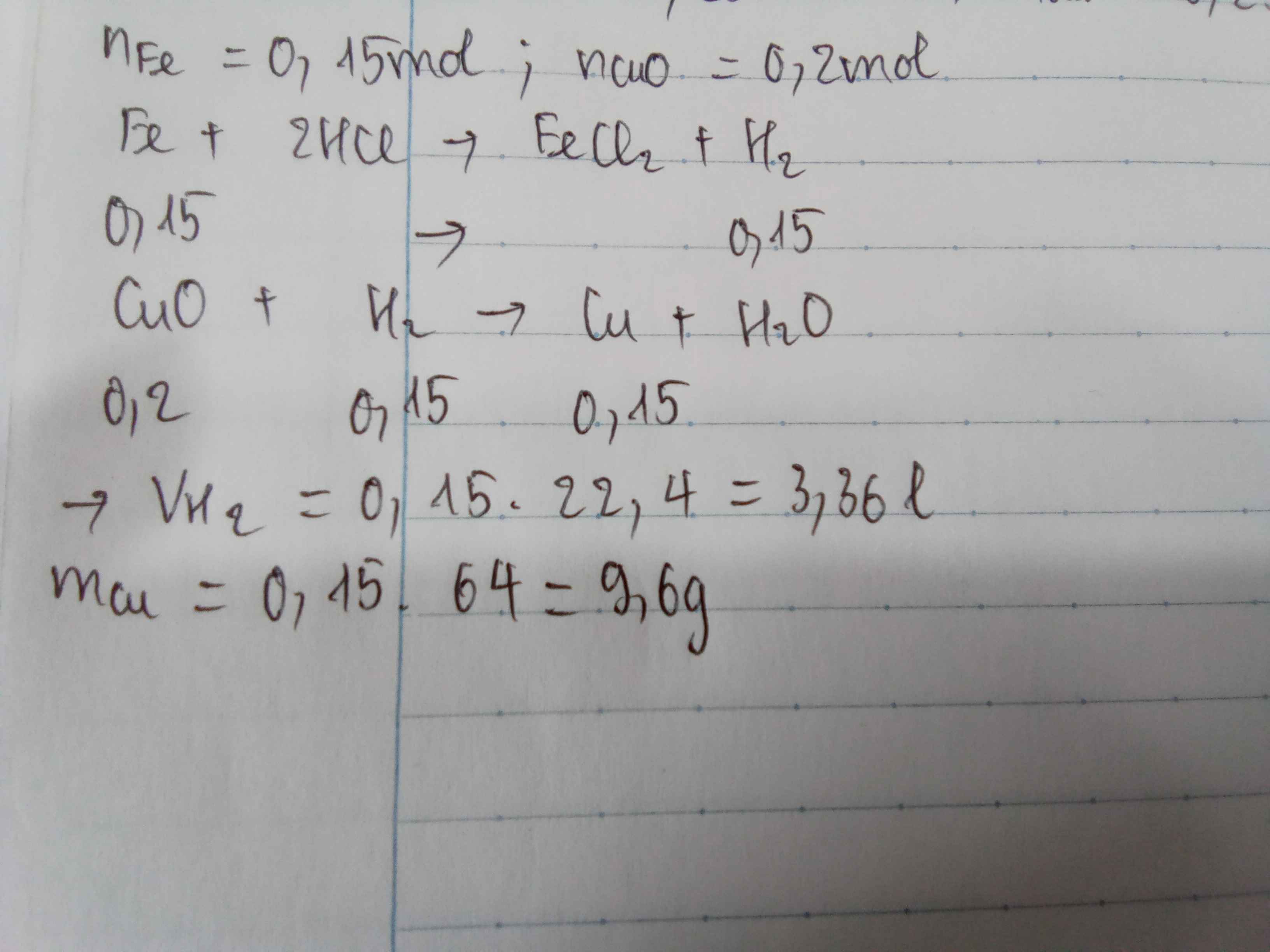

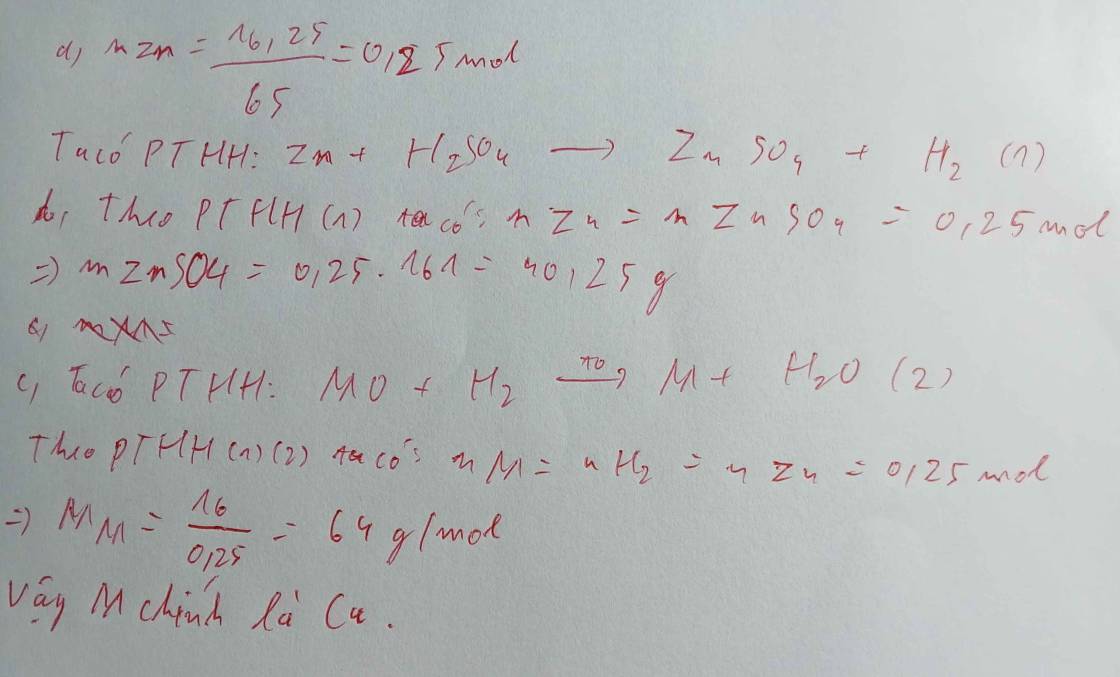
`a)PTHH:`
`Zn + 2HCl -> ZnCl_2 + H_2 \uparrow`
`0,1` `0,2` `0,1` `(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,1` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`n_[HCl]=[10,95]/[36,5]=0,3(mol)`
Ta có: `[0,1]/1 < [0,3]/2`
`=>HCl` dư
`b)V_[H_2]=0,1.22,4=2,24(l)`
`m_[Cu]=0,1.64=6,4(g)`