Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+2HCl--->FeCl_2+H_2\left(1\right)\)
\(CuO+H_2\overset{t^o}{--->}Cu+H_2O\left(2\right)\)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15.22,4=3,36\left(lít\right)\)
b. Ta thấy: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\)
Vậy CuO dư.
Theo PT(2): \(n_{Cu}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)

\(n_{HCl}=0.2\cdot1=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(........0.2..............0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.1.......0.1....0.1\)
\(\Rightarrow CuOdư\)
\(m_{Cu}=0.1\cdot64=6.4\left(g\right)\)

a) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2--------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => H2 hết, CuO dư
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2-------->0,2
=> mrắn sau pư = 24 - 0,2.80 + 0,2.64 = 20,8 (g)
c)
PTHH: RO + H2 --to--> R + H2O
0,2------>0,2
=> \(M_R=\dfrac{12,8}{0,2}=64\left(g/mol\right)\)
=> R là Cu
+) \(N_{Mg}\) = \(\dfrac{m}{M}\) = \(\dfrac{4,8}{24}\) = 0,2 mol
a) Mg + HCl -> \(MgCl_2\) + \(H_2\)
0,2 -> 0,2 (mol)
b) +) \(N_{CuO}\text{ }\)= \(\dfrac{m}{M}\) = \(\dfrac{24}{80}\) = 0,3 mol
+) \(H_2\) + CuO -> Cu + \(H_2O\)
+) Ta có: \(\dfrac{N_{H_2}}{1}\)= \(\dfrac{0,2}{1}\) < \(\dfrac{N_{CuO}}{1}\)= \(\dfrac{0,3}{1}\)
=> \(H_2\) hết. Tính toán theo \(N_{H_2}\)
+)\(H_2\) + CuO -> Cu + \(H_2O\)
Ban đầu: 0,2 0,3 0 0 }
P/ứng: 0,2 -> 0,2 -> 0,2 -> 0,2 } mol
Sau p/ư: 0 0,1 0,2 0,2 }
=> \(m_{Cu}\) = 12,8 gam .Thu được 2,8 gam Cu

a. \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT ta có: \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
b. \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PTHH: \(H_2+CuO\rightarrow Cu+H_2O\)
Theo PT ta có tỉ lệ:
\(\dfrac{0,15}{1}< \dfrac{0,2}{1}\) => CuO dư. \(H_2\) hết => tính theo \(n_{H_2}\)
\(n_{Cu}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)

a) nFe = \(\dfrac{8,4}{56}=0,15\) mol
Pt: Fe + 2HCl --> FeCl2 + H2
0,15 mol-------------------> 0,15 mol
VH2 sinh ra = 0,15 . 22,4 = 3,36 (lít)
b) nCuO = \(\dfrac{16}{80}=0,2\) mol
Pt: CuO + H2 --to--> Cu + H2O
...............0,15 mol-> 0,15 mol
Xét tỉ lệ mol giữa CuO và H2:
\(\dfrac{0,2}{1}>\dfrac{0,15}{1}\)
Vậy CuO dư
mCu thu được = 0,15 . 64 = 9,6 (g)

a) nAl = 43,2/27 = 1,6 mol
2Al + 6HCl → 2AlCl3 + 3H2
1,6 \(\dfrac{1,6\times3}{2}=2,4\)
→ nH2 = 2,4 mol → VH2 = 2,4 x 22, 4 = 53,76 lít
b) nCuO = 64/80 = 0,8 mol
nH2 = 2,4 mol
→ H2 dư, phương trình tính theo số mol của CuO
CuO + H2 → Cu + H2O
0,8 0,8 0,8 0,8
Chất rắn sau phản ứng có Cu
mCu = 0,8 x 64 = 51,2 gam
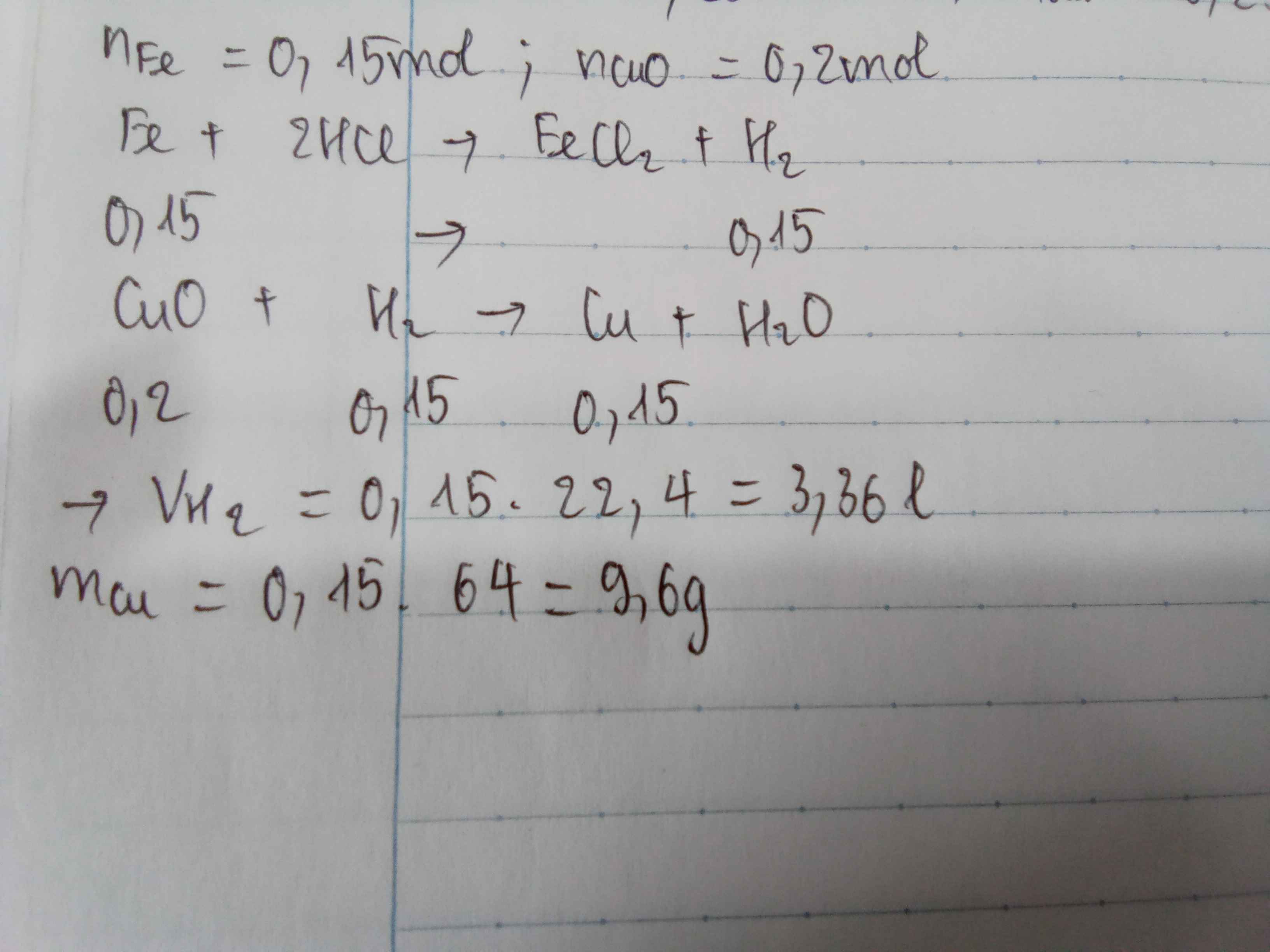


Mik làm rồi nhé
Bn vuối xuống dưới là thấy