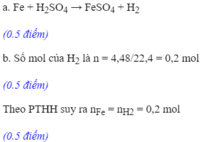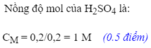Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{3,36}{22,4}=0,15mol\)
a. PTHH: Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
TL: 1 1 1 1
mol: 0,15 \(\leftarrow\) 0,15 \(\leftarrow\) 0,15 \(\leftarrow\) 0,15
\(b.m_{Fe}=n.M=0,15.56=8,4g\)
Đổi 150ml = 0,15 l
\(c.C_{MddH_2SO_4}=\dfrac{n}{V}=\dfrac{0,15}{0,15}=1M\)

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,3 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
c) \(n_{HCl}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
50ml = 0,05l
\(C_{M_{ddHCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
Chúc bạn học tốt

\(Fe+H_2SO_4 \to FeSO_4+H_2\\ n_{H_2}=0,15(mol)\\ a/\\ n_{Fe}=n_{H_2}=0,15(mol)\\ m_{Fe}=0,15.56=8,4(g)\\ b/\\ n_{H_2SO_4}=n_{H_2}=0,15(mol)\\ CM_{H_2SO_4}=\dfrac{0,15}{2}=0,75M c/\\ n_{FeSO_4}=n_{H_2}=0,15(mol)\\ CM_{FeSO_4}=\dfrac{0,15}{0,2}=0,75M\\\)

Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
a) Pt : 2Al +6HCl → 2AlCl3 + 3H2\(|\)
2 6 2 3
0,5 1,5 0,75
a) Số mol của nhôm
nAl = \(\dfrac{0,75.2}{3}=0,5\left(mol\right)\)
Khối lượng của nhôm
mAl = nAl . MAl
= 0,5 .27
= 13,5 (g)
c) Số mol của dung dịch axit clohidric
nHCl = \(\dfrac{0,5.6}{2}=1,5\left(mol\right)\)
500ml = 0,5l
Nồng độ mol của dung dịch axit clohdric đã dùng
CMHCl = \(\dfrac{n}{V}=\dfrac{1,5}{0,5}=3\left(M\right)\)
Chúc bạn học tốt
2Al+6HCl->2AlCL3+3H2
=>nAl=\(\dfrac{2}{3}\)nH2=\(\dfrac{2}{3}\).16,8/22.4=0,5mol
=>mAl=27.0,5=13,5g
=>nHCl=2nH2=2.16,8/22,4=1,5mol
\(=>Cm=\dfrac{1,5}{\dfrac{500}{1000}}=3M\)

Bài 7:
a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b) Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Zn\left(pư\right)}\)
\(\Rightarrow m_{Zn\left(pư\right)}=0,2\cdot65=13\left(g\right)\)
c) Theo PTHH: \(n_{HCl}=2n_{H_2}=0,4mol\) \(\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
(Coi như thể tích dd thay đổi không đáng kể)
PTHH: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
Gộp cả phần a và b
Ta có: \(n_{CO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)=n_{Ca\left(OH\right)_2}=n_{CaCO_3}\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\\m_{CaCO_3}=0,05\cdot100=5\left(g\right)\end{matrix}\right.\)

\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,3 0,15
\(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(n_{HCl}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
50ml = 0,05l
\(C_{M_{HCl}}=\dfrac{0,3}{0,05}=6\left(M\right)\)
Chúc bạn học tốt

a) `n_{H_2} = (3,36)/(22,4) = 0,15 (mol)`
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
Theo PT: `n_{Fe} = n_{H_2} = 0,15 (mol)`
`=> m_{Fe} = 0,15.56 = 8,4 (g)`
b) Theo PT: `n_{HCl} = 2n_{H_2} = 0,3 (mol)`
`=> m_{ddHCl} = (0,3.36,5)/(16\%) = 68,4375 (g)`