Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) 2Al + 6HCl -> 2AlCl3 + 3H2
Al2O3 + 6HCl -> 2AlCl3 + 3H2O
nH2 = 0,15mol => nAl=0,1mol => mAl=2,7g; mAl2O3 = 10,2g => nAl2O3 = 0,1mol
=>%mAl=20,93% =>%mAl2O3 = 79,07%
b) nHCl = 0,1.3+0,1.6=0,9 mol=>mHCl(dd)=100g
mddY=12,9+100-0,15.2=112,6g
mAlCl3=22,5g=>C%=19,98%

\(m_O=\dfrac{15.12,8}{100}=1,92\left(g\right)\)
=> \(n_O=\dfrac{1,92}{16}=0,12\left(mol\right)\)
=> \(n_{H_2O}=0,12\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Bảo toàn H: nHCl = 0,12.2 + 0,15.2 = 0,54 (mol)
=> nCl = 0,54 (mol)
mmuối = mhh rắn - mO + mCl
= 15 - 1,92 + 0,54.35,5 = 32,25 (g)

Bài 1:
\(n_{HCl}=2.0,16=0,32\left(mol\right);n_{H_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
PTHH: Fe + 2HCl → FeCl2 + H2
\(m_{H_2}=0,16.2=0,32\left(g\right)\)
\(m_{HCl}=0,32.36,5=11,68\left(g\right)\)
Theo ĐLBTKL ta có: \(m_{MgCl_2+FeCl_2}=1,4+11,68-0,32=12,76\left(g\right)\)
Bài 12:
Theo ĐLBTKL, ta có:
\(m_{hhkl}+m_{O_2}=m_{hh.oxit}\\ \Leftrightarrow11,9+m_{O_2}=18,3\\ \Leftrightarrow m_{O_2}=18,3-11,9=6,4\left(g\right)\\ n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

Đáp án A
Số mol H 2 thu được là: n H 2 = 2 , 24 22 , 4 = 0 , 1 mol
Sơ đồ phản ứng hóa học:


\(4.\)
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.15.....0.3....................0.15\)
\(m_{Fe}=0.15\cdot56=8.4\left(g\right)\)
\(C_{M_{HCl}}=\dfrac{0.3}{0.5}=0.6\left(M\right)\)
\(5.\)
\(Đặt:n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(m_{hh}=56a+27b=8.3\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow a+1.5b=0.25\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(\%Fe=\dfrac{5.6}{8.3}\cdot100\%=67.47\%\)
\(\%Al=32.53\%\)
bạn ơi cho mik hỏi: tại sao lại suy ra: a+1,5b=0,25 vậy ạ ? và cả bước tiếp theo nx ạ ?
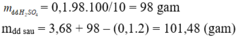
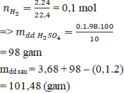

Phản ứng xảy ra:
\(2Al+6HCl\rightarrow2Alcl_3+3H_2\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
Ta có:
\(n_{H_2}=\frac{3,36}{22,4}=0,15mol\)
\(\rightarrow n_{Al}=\frac{2}{3}n_{H_2}=0,1mol\)
\(\rightarrow m_{Al}=0,1.27=2,7gam\rightarrow m_{Al_2O_2}=10,2gam\)
\(\rightarrow\%m_{Al}=\frac{2,7}{12,9}=20,93\%\rightarrow\%m_{Al_2O_2}=79,07\%\)
\(n_{Al_2O_3}=\frac{10,2}{27.2+16.3}=0,1mol\)
\(\rightarrow n_{HCl}=3n_{Al}+6n_{Al_2O_3}=0,1.3+0,1.6=0,9mol\)
\(\rightarrow m_{HCl}=0,9.36,5=32,85gam\)
\(\rightarrow m_{ddHCl}=\frac{32,85}{3,65\%}=900gam\)