Để thu được 2 tấn gang thành phần ( cc 90% sắt) thì người ta sản xuất cần dùng bao nhiêu tấn quặng hemmatite? Biết quặng hemmatite chuaứ 60% hàm lượng Fe2O3 và hiệu suất của quá trình sản xuất là 80%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Ta có: m(Fe2O3) = 7.103 (kg) → n(Fe2O3) = 4,375 mol → n(Fe trong gang) = 4,375. 2 = 8,75
→ m(Fe trong gang) = 490 → m(gang) = 490. 100 : 95 = 515,8 (kg)

Đáp án B
Ta có: m(Fe2O3) = 7.103 (kg) → n(Fe2O3) = 4,375 mol → n(Fe trong gang) = 4,375. 2 = 8,75
→ m(Fe
trong gang) = 490 → m(gang) = 490. 100 : 95 = 515,8 (kg) Câu 86: Đáp án D
Gọi n(Fe) = a và n(C) = b → 56a + 12b = 99,2
BT e: 3a + 4b =2n(SO2) → n(SO2) = 1,5a + 2b
→ n(hh khí) = 1,5a + 2b + b = 1,5a + 3b = 2,925
→ a = 1,75 và b = 0,1 → % = 0,1. 12. 100% : 99,2 = 1,21%

Đáp án A
Gọi n(Fe) = a và n(Cu) = b → 56x + 64y = 15,2
BT e: 3x + 2y = 3n(NO) = 0,6
→ x = 0,1 và y = 0,15 → m(Cu) = 9,6 → % = 63,16%

Khối lượng Fe có trong gang là mFe = 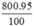 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 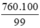 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 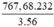 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 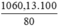 = 1325,163 (tấn)
= 1325,163 (tấn)





Ta có: mFe = 2.90% = 1,8 (tấn) = 1800 (kg)
\(\Rightarrow n_{Fe}=\dfrac{1800}{56}=\dfrac{225}{7}\left(kmol\right)\)
\(\Rightarrow n_{Fe_2O_3\left(LT\right)}=\dfrac{1}{2}n_{Fe}=\dfrac{225}{14}\left(kmol\right)\)
Mà: H% = 80%
\(\Rightarrow n_{Fe_2O_3\left(TT\right)}=\dfrac{\dfrac{225}{14}}{80\%}=\dfrac{1125}{56}\left(kmol\right)\)
⇒ mFe2O3 = 1125/56.160 = 22500/7 (kg)
⇒ m quặng = mFe2O3:60% = 5357 (kg) = 5,36 (tấn)