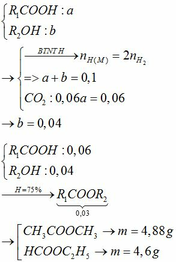
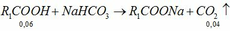Cho hỗn hợp x gồm hai chất CH3COOH và C2H5OH cho m gam hỗn hợp X tác dụng với Na dư thì thu được 6,72 lít khí hidro các chất khí đó ở điều kiện tiêu chuẩn A viết phương trình hóa học xảy ra b tính phần trăm mỗi chất X C nếu đem toàn bộ hỗn hợp X đun nóng có mặt H2SO4 đặc hoặc xúc tác để thực hiện phản ứng Este hóa thì thu được bao nhiêu gam etylic x Star biết hiệu suất phản ứng Este hóa là 80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
b) \(n_{Fe}=n_{H2}=n_{H2SO4}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Al2O3}=15,8-5,6=10,2\left(g\right)\)
c) Ta có : \(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\Rightarrow n_{H2SO4}=3n_{Al2O3}=0,3\left(mol\right)\)
\(C_{MddH2SO4}=\dfrac{0,1+0,3}{0,2}=2M\)

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Zn}\) \(\Rightarrow n_{ZnO}=\dfrac{20-0,1\cdot65}{81}=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow n_{ZnCl_2}=n_{Zn}+n_{ZnO}=\dfrac{4}{15}\left(mol\right)\)
Mặt khác: \(m_{H_2}=0,1\cdot2=0,2\left(g\right)\)
\(\Rightarrow m_{dd}=m_{hh}+m_{ddHCl}-m_{H_2}=119,8\left(g\right)\) \(\Rightarrow C\%_{ZnCl_2}=\dfrac{\dfrac{4}{15}\cdot136}{119,8}\cdot100\%\approx30,27\%\)
c) Giả sử khí là SO2
PTHH: \(Zn+H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}ZnSO_4+SO_2\uparrow+H_2O\)
Theo PTHH: \(n_{SO_2}=n_{Zn}=0,1\left(mol\right)\) \(\Rightarrow V_{SO_2}=0,1\cdot22,4=2,24\left(l\right)\)

PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
Ta có: 23nNa + 137nBa = 18,3 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Ba}=0,2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Na}=0,2\left(mol\right)\\n_{Ba}=0,1\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{NaOH}=n_{Na}=0,2\left(mol\right)\\n_{Ba\left(OH\right)_2}=n_{Ba}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{NaOH}}=\dfrac{0,2}{0,2}=1\left(M\right)\\C_{M_{Ba\left(OH\right)_2}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ b.Đặt:\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\\ n_{H_2}=\dfrac{18,48}{22,4}=0,825\left(mol\right)\\ Tacó:\left\{{}\begin{matrix}24x+27y=17,1\\x+\dfrac{3}{2}y=0.825\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,375\\y=0,3\end{matrix}\right.\\ \Rightarrow\%m_{Mg}=\dfrac{0,375.24}{17,1}.100=52,63\%\\ \%m_{Al}=47,37\%\)