Hòa tan hoàn toàn m gam bột sắt bằng 50 gam dung dịch HCI 14,6% (vừa đủ). Sau phản ứng thu được dung dịch X và khí H_{2} (đktc). Làm lạnh để dung dịch kết tỉnh, sau một thời gian tách ra được 4,975 gam tinh thể FeC*l_{2} * 0.4H_{2}*O và còn lại dung dịch Y. Tính nồng độ phần trăm FcC*l_{2} còn lại trong Y (giả sử nước bay hơi không đáng kể trong suốt quá trình trên).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : D
Sau phản ứng nhiệt nhôm thu được : x mol Al ; y mol Cr2O3 ; z mol Cr và t mol Al2O3
Do phản ứng hoàn toàn nên Y không có Al hoặc không có Cr2O3
=> Bảo toàn khối lượng : mX = mY = 27.(x+2t) + 152.(y+0,5z) = 15,4g (1)
nHCl = 3nAl + 6nAl2O3 + 6nCr2O3 + 2nCr = 3x + 6t + 6y + 2z = 0,9 mol (2)
,nH2 = 1,5nAl + nCr => 3x + 2z = 0,06.2 = 0,12 mol (3)
Từ (2),(3) => y + t = 0,13 mol
=> nNaOH = 4nAlCl3 + 4nCrCl3 + 2nCrCl2 = 4(x+2t) + 4.2y + 2z = 8y + 8t + 4x + 2z
+) TH1 : Không có Al => x = 0 => z = 0,06 mol
=> 54t + 152y = 10,84g và t + y = 0,13
=> t = 0,09 và y = 0,04 => nNaOH pứ = 1,02 mol => m =40,8g
+)TH2 : Không có Cr2O3 => y = 0 => t = 0,13 mol
=> 27x + 76z = 8,38g và 3x + 2z = 0,06
=> x = - 0,07 mol (L)

Chọn B.
Dung dịch X chứa Mg(NO3)2 và Cu(NO3)2 . Khi cho X tác dụng với Fe thì:
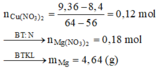

Dung dịch X chứa Mg(NO3)2 (a mol) và Cu(NO3)2 dư (b mol)
Bảo toàn N => 2a + 2b = 0,1 + 0,25.2
X với Fe: ∆ m = 64b - 56b = 9,36 - 8,4
Giải hệ được a = 0,18 và b = 0,12
Trong 19,44 gam kết tủa chứa Ag (0,1), Cu
(0,25 - 0,12 = 0,13) => mMg dư = 0,32
m = 0,18.24 + 0,32 = 4,64
Đáp án C

Đáp án : D
Dung dịch X chứa 2 muối chắc chắn là Cu2+ và Mg2+
Trong kết tủa có thể có Mg chưa kịp phản ứng với Cu2+
Thêm 4,2g Fe và thu được 4,68g > mFe => Phản ứng với Cu2+
=> nCu2+ = (4,68 – 4,2)/(64 – 56) = 0,06 mol
=> Dung dịch muối có 0,09 mol Mg2+ ; 0,06 mol Fe2+(bảo toàn điện tích với NO3-)
Bảo toàn khối lượng :
, m + mAgNO3 + Cu(NO3)2 = mKết tủa + mdd X
,mdd X + mFe = mrắn + mdd sau
=> m = 2,32g



`Fe+2HCl->FeCl_2+H_2`
`n_{HCl}={50.14,6\%}/{36,5}=0,2(mol)`
Theo PT: `n_{Fe}=n_{FeCl_2}=n_{H_2}=0,2(mol)`
`->m_{dd\ X}=0,2.56+50-0,2.2=60,8(g)`
`n_{FeCl_{2}.4H_2O}={4,975}/{199}=0,025(mol)`
`->n_{FeCl_2\ tach}=0,025(mol)`
`->C\%_{FeCl_2(Y)}={(0,2-0,025).127}/{60,8-4,975}.100\%\approx 39,81\%`
Anh ko sử dụng hđ nữa hả anh