Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sơ đồ như hình vẽ :

(Lớp K có tối đa 2 electron, lớp L có tối đa 8 electron, lớp M có tối đa 18 electron).

- Hai nguyên tử có số eletron lớp ngoài cùng là 5.
- Hai nguyên tử có số electron ngoài cùng 7.

Số electron tối đa có thể phân bố trên :
Phân lớp s : 2.
Phân lớp p : 6.
Phân lớp d : 10.
Phân lớp f : 14.
Nhận xét: Số electron tối đa trên các phân lớp s, p, d, f gấp 2 lần các số lẻ liên tiếp 1, 3, 5, 7.

Nguyên tử có hạt nhân có số proton lần lượt à 7e+; 9e+; 15e+; 17e+; 19e+.
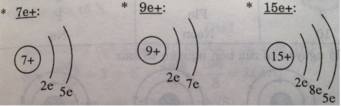


- Chu kì 2 có 2 phân lớp đó là: phân lớp s và phân lớp p
- Phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6 electron
=> Chu kì 2 chỉ chứa được tối đa 8 electron

A
Nguyên tử có 3 lớp electron => Số electron s tối đa là 6.
Vì nguyên tử có 3 lớp electron, số electron p nhỏ nhất là 6 (6 electron trên phân lớp 2p, phân lớp 3p không có electron).
Vậy số electron s = số electron p = 6.
Do đó tại lớp ngoài cùng có 2 electron s và không có electron p.

sai nha, đọc kĩ đề... X chỉ có 3 lớp nên lớp M cũng chỉ còn 8e thôi, câu hỏi mẹo á
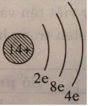

Vì mỗi AO chứa tối đa 2 electron nên số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó.