Trong phòng thí nghiệm , người ta có thể điều chế khí Hydrogen ( H2) bằng cách cho Magnesium tác dụng với dung dịch Hydrochloride ( HCl) theo phương trình hoá học sau Mg + 2HCl --> MgCl2 + H2 Tính khối lượng của Hydrochloride acid tham gia và thể tích khí H2 ( điều kiện tiêu chuẩn) thu được khí hoà tan hoàn toàn 4,8g Magnesium
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4----->0,2--->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
c)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,2----->0,2
=> mCu = 0,2.64 = 12,8 (g)

\(n_{Mg}=\dfrac{9,6}{24}=0,4\left(mol\right)\\ a,PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\\ b,n_{MgCl_2}=n_{H_2}=n_{Mg}=0,4\left(mol\right)\\ m_{MgCl_2}=95.0,4=38\left(g\right)\\ b,V_{H_2\left(đkc\right)}=0,4.24,79=9,916\left(l\right)\\ d,n_{HCl}=0,4.2=0,8\left(mol\right)\\ V_{ddHCl}=\dfrac{0,8}{2}=0,4\left(l\right)\)
cho tui hỏi sao thể tích cần dùng lại tính thêm thể tích hcl vậy ạ

2Al + 6HCL → 2AlCl3 + 3H2
b) nH2 = 4,48 : 22,4= 0,2 mol => nAl = nAlCl3 = 0,2 : 3 . 2 = \(\dfrac{2}{15}\) mol
mAl = \(\dfrac{2}{15}\).27=3.6 g
mAlCl3 = \(\dfrac{2}{15}\)(27+35,5.3) = 17,8 g
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a, PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
_____2/15___________2/15____0,2 (mol)
b, \(m_{Al}=\dfrac{2}{15}.27=3,6\left(g\right)\)
c, \(m_{AlCl_3}=\dfrac{2}{15}.133,5=17,8\left(g\right)\)
Bạn tham khảo nhé!

a: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b: \(m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\)
c: Khối lượng của Mg tham gia phản ứng là:
\(0.4+19-14.6=4.8\left(g\right)\)

4HCl + Mn O 2 → Mn Cl 2 + Cl 2 + 2 H 2 O
16HCl + 2KMn O 4 → 2KCl + 2Mn Cl 2 + 5 Cl 2 + 8 H 2
2NaCl + 2 H 2 O → 2NaOH + H 2 + Cl 2

a.b.
\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
c.
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,3 > 0,2 ( mol )
0,2 0,2 ( mol )
\(m_{Cu}=0,2.64=12,8g\)

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Có \(\Sigma n_{H_2}=n_{Mg}+n_{Zn}=0,6\)
Mà \(n_{Mg}=n_{Zn}\Rightarrow n_{Mg}=n_{Zn}=0,3mol\)
\(m_{Mg}=0,3\cdot24=7,2g\)
\(m_{Zn}=0,3\cdot65=19,5g\)
\(\Sigma n_{HCl}=2n_{Mg}+2n_{Zn}=2\cdot0,3+2\cdot0,3=1,2mol\)
\(\Rightarrow m_{HCl}=1,2\cdot36,5=43,8g\)

\(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(m_{Zn}=0,1.65=6,5\left(g\right)\)
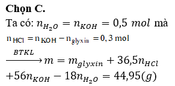
Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)