Nung 6,72g Fe trong không khí thu đc iron(2) oxide . Tính mFeo và VO2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTPU: Fe + O2 -> Fe2O3
Áp dụng định luật BTKL:
mFe + mO2 = mFe2O3
=> mFe2O3 = 23,2 - 16,8 = 6,4g
=> Chọn C
PTHH: \(3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
Ta thấy: \(\dfrac{0,3}{3}=\dfrac{0,1}{1}\)
=> Không có chất dư.
Theo PT: \(n_{O_2}=2.n_{Fe_3O_4}=2.0,1=0,2\left(mol\right)\)
=> \(m_{O_2}=0,2.32=6,4\left(g\right)\)
Chọn C

\(n_{O_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ n_{Fe}=\dfrac{3}{2}.n_{O_2}=1,5.0,15=0,225\left(mol\right)\\ \Rightarrow m_{Fe}=0,225.56=12,6\left(g\right)\\ n_{Fe_3O_4}=\dfrac{n_{O_2}}{2}=\dfrac{0,15}{2}=0,075\left(mol\right)\\ \Rightarrow m_{Fe_3O_4}=232.0,075=17,4\left(g\right)\)

\(n_{Fe}=\dfrac{50,4}{56}=0,9\left(mol\right)\\ PTHH:3Fe+2O_2\rightarrow^{t^o}Fe_3O_4\\ \Rightarrow n_{Fe_3O_4}=\dfrac{n_{Fe}}{3}=0,3\left(mol\right)\\ \Rightarrow m_{Fe_3O_4}=0,3\cdot232=69,6\left(g\right)\)

Bài 4:
a)
Gọi số mol CO, H2 trong mỗi phần là a, b (mol)
=> 28a + 2b = 1,14 (1)
+ Phần 1:
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
\(\dfrac{1}{3}b\)<----b-------->\(\dfrac{2}{3}b\)
Fe2O3 + 3CO --to--> 2Fe + 3CO2
\(\dfrac{1}{3}a\)<---a----------->\(\dfrac{2}{3}a\)
=> \(\dfrac{2}{3}a+\dfrac{2}{3}b=\dfrac{6,72}{56}=0,12\)
=> a + b = 0,18 (2)
(1)(2) => a = 0,03 (mol); b = 0,15 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,03}{0,03+0,15}.100\%=16,67\%\\\%V_{H_2}=\dfrac{0,15}{0,03+0,15}.100\%=83,33\%\end{matrix}\right.\)
b) \(n_{Fe_2O_3}=\dfrac{1}{3}a+\dfrac{1}{3}b=0,06\left(mol\right)\)
=> mFe2O3 = 0,06.160 = 9,6 (g)
c)
\(n_{O_2}=\dfrac{11,2.20\%}{22,4}=0,1\left(mol\right)\)
\(n_{N_2}=\dfrac{11,2.80\%}{22,4}=0,4\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
0,03->0,015-->0,03
2H2 + O2 --to--> 2H2O
0,15->0,075
=> B chứa \(\left\{{}\begin{matrix}CO_2:0,03\left(mol\right)\\O_2:0,1-\left(0,015+0,075\right)=0,01\left(mol\right)\\N_2:0,4\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{0,03.44+0,01.32+0,4.28}{0,03+0,01+0,4}=\dfrac{321}{11}\left(g/mol\right)\)
=> \(d_{B/C_2H_6}=\dfrac{\dfrac{321}{11}}{30}=\dfrac{107}{110}\)

nFe2O3 = 32/160 = 0,2 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
Mol: 0,2 ---> 0,6 ---> 0,4
mFe = 0,4 . 56 = 22,4 (g)
VH2 = 0,6 . 24,79 = 14,874 (l)
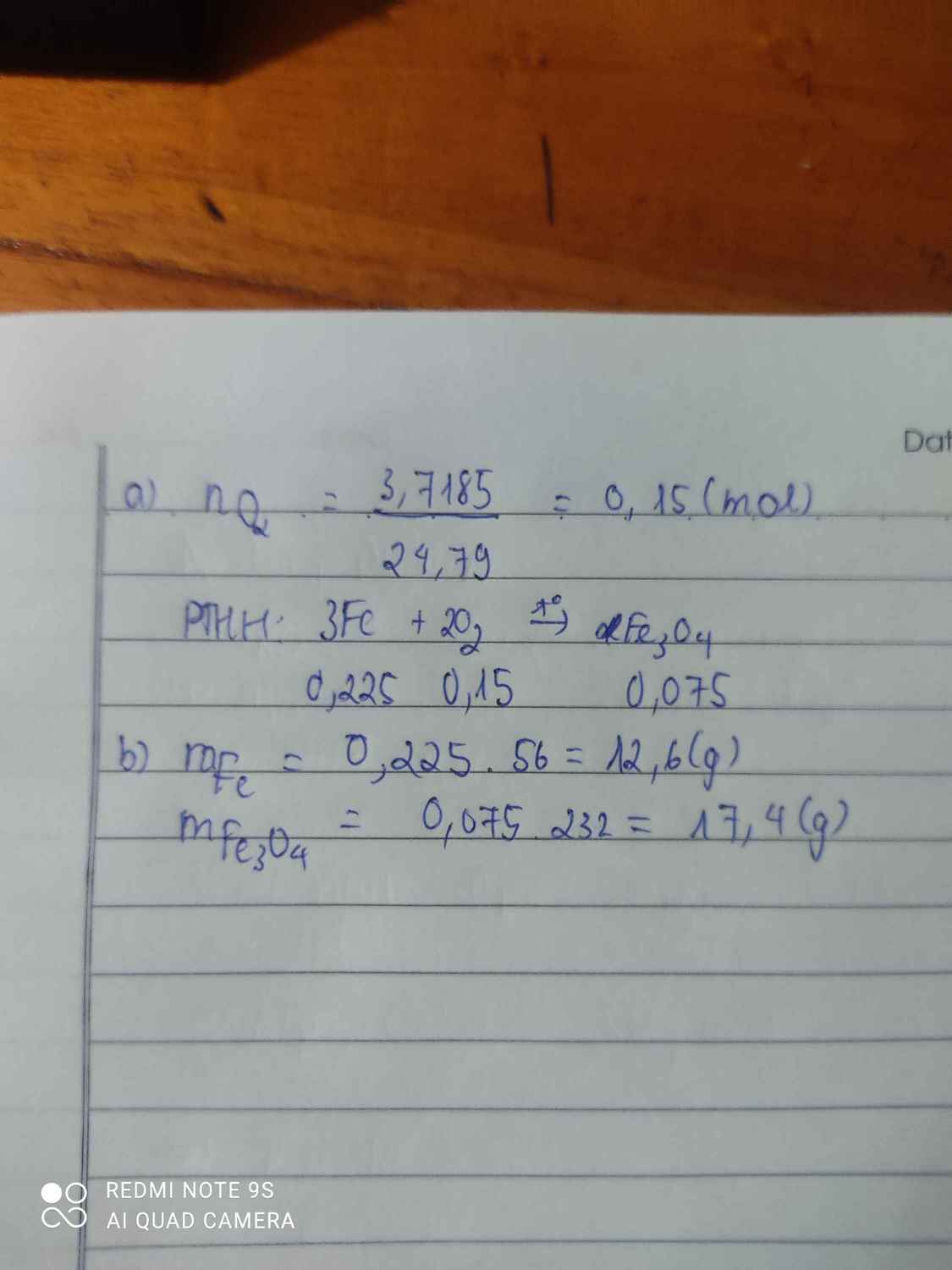
\(n_{Fe}=\dfrac{6,72}{56}=0,12mol\\ 2Fe+O_2\xrightarrow[]{t^0}2FeO\)
0,12 0,06 0,12
\(m_{FeO}=0,12.72=8,64g\\ V_{O_2}=0,06.24,79=1,4874l\)
fgsr