Cho 0,5 gam bột iron vào bình đựng 25 mL dung dịch CuSO4 0,2M ở 32oC. Khuấy điều dung
dịch, quan sát nhiệt kế thấy nhiệt độ lên cao nhất là 39oC. Giả thuyết nhiệt lượng của phản
ứng tỏa ra được dung dịch hấp thụ hết, nhiệt dung của dung dịch loãng bằng nhiệt dung của
nước (4,2J/g.K). Biến thiên enthalpy chuẩn của phản ứng này bằng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tóm tắt:
\(m_1=400g=0,4kg\)
\(t_1=85^oC\)
\(m_2=200g=0,2kg\)
\(t_2=25^oC\)
\(t=35^oC\)
\(c_1=380J/kg.K\)
\(c_2=4200J/kg.K\)
=========
a) \(t=?^oC\)
b) \(Q_2=?J\)
c) \(t_1'=60^oC\)
\(m'=500g=0,5kg\)
\(t'=?^oC\)
a) Nhiệt độ của đồng ngay khi có cân bằng là: \(t=35^oC\)
b) Nhiệt lượng nước thu vào:
\(Q_2=m_2.c_2.\left(t-t_2\right)=0,2.4200.\left(35-25\right)=8400J\)
c) Nhiệt độ khi có cân bằng là:
Theo pt cân bằng nhiệt:
\(Q=Q'\)
\(\Leftrightarrow\left(m_1c_1+m_2c_2\right)\left(t'-t\right)=m'c_2.\left(t_1'-t'\right)\)
\(\Leftrightarrow\left(0,4.380+0,2.4200\right).\left(t'-35\right)=0,5.4200.\left(60-t'\right)\)
\(\Leftrightarrow t'=52^oC^o\)

(1), (2) Thay a gam Fe hạt thành a gam Fe bột hoặc dạng lá → làm tăng diện tích tiếp xúc của
Fe với H2SO4 → làm tăng tốc độ
(3) 0,5 M < b → làm giảm nồng độ của H2SO4 → làm giảm tốc độ phản ứng
(4) Tăng thể tích H2SO4 làm giảm nồng độ H2SO4 →tốc độ phản ứng giảm
(5) Tăng gấp đôi nồng độ phản ứng → tốc độ phản ứng tăng
(6) Tăng nhiệt độ tốc độ phản ứng tăng
Vậy có 4 yếu tố làm tăng tốc độ phản ứng. Đáp án C.

Đáp án C
nMg = 0,04. Thứ tự các phản ứng xảy ra:
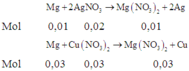
Do đó dung dịch B có chứa 0,04 mol Mg(NO3)2 và Cu(NO3)2 dư.
Khi cho NH3 dư vào B thu được kết tủa duy nhất là Mg(OH)2 (Cu(OH)2 tạo phức tan được NH3)
Đem nung kết tủa thì được chất rắn là MgO. Có nMgO = n M g ( N O 3 ) 2 = 0,04
Vậy mMgO = 1,6 (gam)

1.
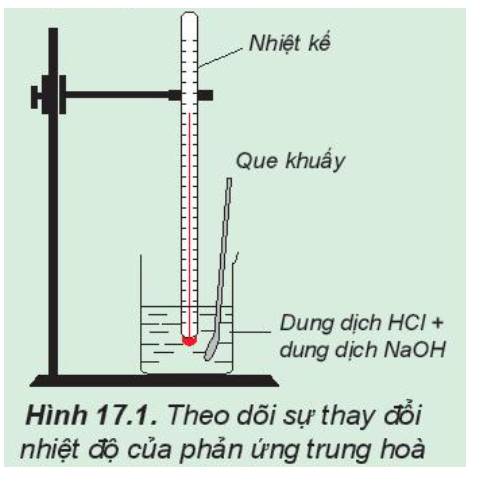
Phản ứng hóa học: NaOH + HCl → NaCl + H2O
Nhiệt độ đo được (HCl) lúc ban đầu thấp hơn so với nhiệt độ sau phản ứng
=> Phản ứng trung hòa là phản ứng tỏa nhiệt
2.
Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ sau phản ứng vẫn tăng nhưng tăng ít hơn so với thí nghiệm trên.


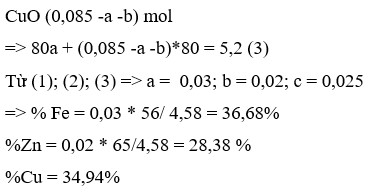
\(Q=25\cdot4,2\cdot7=735J\\ \Delta_rH^o_{298}=\dfrac{0,735kJ}{0,025\cdot0,2mol}=147kJ\cdot mol^{-1}\)