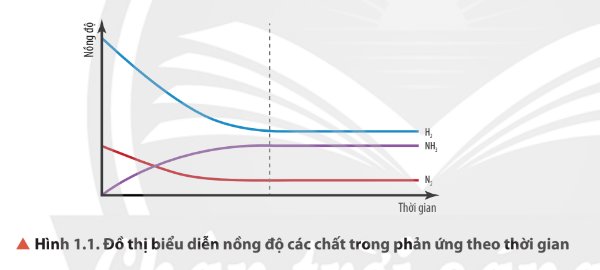
Quan sát Hình 1.1, nhận xét sự biến thiên nồng độ của các chất trong hệ phản ứng theo thời gian (với điều kiện nhiệt độ không đổi).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Ban đầu:
+ Tốc độ phản ứng thuận giảm dần;
+ Tốc độ phản ứng nghịch tăng dần;
- Đến thời điểm cân bằng: Tốc độ phản ứng thuận = tốc độ phản ứng nghịch.

-Khi tăng nồng độ chất hay nhiệt độ, độ PH, tốc độ phản ứng sẽ thay đổi như sau:
+Khi tăng nồng độ cơ chất, tốc độ phản ứng sẽ tăng nhưng khi đạt tới mức bão hòa thì tốc độ phản ứng sẽ không tăng làm cho không tăng tốc độ phản ứng
+Khi tăng nhiệt độ, tốc độ phản ứng sẽ tăng và đạt mức cực đại ở mức tối ưu. Sau mức đó thì nhiệt độ đó sẽ giảm dần
+Khi tăng độ PH, tốc độ phản ứng sẽ tăng và đạt cao nhất ở độ pH tối ưu, vượt qua pH tối ưu thì tốc độ phản ứng sẽ giảm.
-Nhận xét: Ở nhiệt độ tối ưu và pH tối ưu tốc độ phản ứng do enzyme xúc tác là cực đại.

C.Sự có mặt chất xúc tác. Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc đọ phản ứng nghịch với số lần bằng nhau. Do vậy, chất xúc tác không làm chuyển dịch cân bằng hóa học hay không làm nồng độ các chất trong cân bằng biến đổi

a, Nhiệt độ sôi tăng dần theo độ lớn của PTK
b, Ở nhiệt độ phòng, cả 4 chất này đều là chất khí.

Đáp án A
1, đúng
2, đúng
3, đúng
4, sai, nồng độ các chất sẽ không thay đổi ở trạng thái cân bằng (ở đây giả thiết các điều kiện khác không đổi)
5, sai, ở trạng thái cân bằng, phản ứng thuận và nghịch vẫn tiếp tục, nhưng nồng độ các chất đều không đổi.
=> Đáp án A

1) đúng
2) đúng
3) đúng
4) sai, nồng độ các chất sẽ không thay đổi ở trạng thái cân bằng (ở đây giả thiết các điều kiện khác không đổi)
5) sai, ở trạng thái cân bằng, phản ứng thuận và nghịch tiếp tục, nhưng nồng độ các chất đều không đổi
Đáp án A

b) Từ đồ thị ta thấy: Lúc đầu số mol sản phẩm bằng 0, theo thời gian, số mol chất tham gia (hydrogen, iodine) giảm dần, số mol chất sản phẩm (hydrogen iodide) tăng dần, đến khi số mol của các chất hydrogen, iodine, hydrogen iodide không thay đổi nữa.
c) Biểu thức định luật tác dụng khối lượng:
- Đối với phản ứng thuận:
vthuận = \({\rm{k}}{\rm{.}}{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}}{\rm{.}}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}}\)
- Đối với phản ứng nghịch:
vnghịch = \({\rm{k'}}{\rm{.C}}_{{\rm{HI}}}^2\)
Dự đoán:
- Ban đầu tốc độ phản ứng thuận giảm dần, sau một thời gian tốc độ phản ứng thuận không thay đổi theo thời gian.
- Ban đầu tốc độ phản ứng nghịch tăng dần, sau một thời gian tốc độ phản ứng nghịch không thay đổi theo thời gian.
d) Tại thời điểm phản ứng thuận nghịch đạt tới trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì số mol các chất trong hệ phản ứng không thay đổi nữa.
\(\left[N_2\right],\left[H_2\right]\) giảm, \(\left[NH_3\right]\) tăng.
Sau mốc thời gian nhất định, nồng độ các chất không thay đổi.