Tính nồng độ mol của dung dịch H2SO4 14%, khối lượng riêng 1,08g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1) Ta có: \(m_{H_2SO_4}=200\cdot15\%+300\cdot25\%=105\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{105}{200+300}\cdot100\%=21\%\)
2) Ta có: \(\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{105}{98}=\dfrac{15}{14}\left(mol\right)\\V_{ddH_2SO_4}=\dfrac{500}{1,25}=400\left(ml\right)\end{matrix}\right.\) \(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{\dfrac{15}{14}}{0,4}\approx2,68\left(M\right)\)

\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,1-------------->0,1---->0,05
=> VH2 = 0,05.22,4 = 1,12 (l)
mdd sau pư = 2,3 + 197,8 - 0,05.2 = 200 (g)
=> \(C\%=\dfrac{0,1.40}{200}.100\%=2\%\)
\(V_{dd}=\dfrac{200}{1,08}=\dfrac{5000}{27}\left(ml\right)=\dfrac{5}{27}\left(l\right)\)
=> \(C_M=\dfrac{0,1}{\dfrac{5}{27}}=0,54M\)

Ta có: \(m_{ddCuSO_4}=\dfrac{3}{15\%}=20\left(g\right)\)
\(V_{ddCuSO_4}=\dfrac{20}{1,15}\approx17,39\left(ml\right)\)
Ta có: \(n_{CuSO_4}=\dfrac{3}{160}=0,01875\left(mol\right)\)
\(\Rightarrow C_{M_{CuSO_4}}=\dfrac{0,01875}{0,01739}\approx1,08M\)
Bạn tham khảo nhé!

2Na + 2 H2O -> 2NaOH + H2
0,1 mol 0,1 mol
nNa = 2,3:23 = 0,1 mol
mdd sau phản ứng = ( 2,3 +197,8 ) - 0,1*2 = 199,9 g
Vdd sau phản ứng = mdd : D = 199,9 :1,08 \(\approx\)185,1 ml
nồng độ mol của dd là
CM = n : V = 0,1 : 0,1851 \(\approx\)0,54 M

a, \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
b, \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Ca\left(OH\right)_2}=n_{CaO}=0,2\left(mol\right)\Rightarrow C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
c, \(Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\)
Theo PT: \(n_{H_2SO_4}=n_{Ca\left(OH\right)_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,2.98}{15\%}=\dfrac{392}{3}\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{\dfrac{392}{3}}{1,05}\approx124,44\left(ml\right)\)

1. \(n_{Na_2O}=\dfrac{15,5}{62}=0,25\left(mol\right)\)
PTHH: Na2O + H2O → 2NaOH
Mol: 0,25 0,5
\(C_{M_{ddNaOH}}=\dfrac{0,5}{0,5}=1M\)
2.
PTHH: 2NaOH + H2SO4 → Na2SO4 + 2H2O
Mol: 0,5 0,25
\(m_{ddH_2SO_4}=\dfrac{0,25.98.100}{20}=122,5\left(g\right)\)
\(V_{ddH_2SO_4}=\dfrac{122,5}{1,14}=107,456\left(ml\right)\)
\(n_{Na2O}=\dfrac{m_{Na2O}}{M_{Na2O}}=0,25\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,25 mol - 0,25 mol - 0,5 mol
a) \(C_{M_{NaOH}}=\dfrac{n_{NaOH}}{V_{NaOH}}=1\left(M\right)\)
b) \(H_2SO_4+2NaOH\rightarrow Na_2SO4+2H_2O\)
0,25 mol - 0,5 mol - 0,25 mol - 0,5 mol
\(m_{ctH2SO4}=n_{H2SO4}.M_{H2SO4}=24,5\left(g\right)\)
\(C_{\%_{H2SO4}}=\dfrac{m_{ctH2SO4}}{m_{ddH2SO4}}.100\%\)
\(\Rightarrow m_{ddH2SO4}=\dfrac{m_{ctH2SO4}.100\%}{C_{\%_{H2SO4}}}=122,5\left(g\right)\)
\(D_{H2SO4}=\dfrac{m_{ddH2SO4}}{V_{H2SO4}}\Rightarrow V_{H2SO4}=\dfrac{m_{ddH2SO4}}{D_{H2SO4}}\approx107,46\left(ml\right)\)
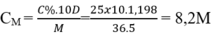
Coi m dd H2SO4 = 98(gam)
=> V dd = m / D = 98/1,08 = 90,74(ml) = 0,9074(lít)
n H2SO4 = 98.14%/98 = 0,14(mol)
Vậy :
CM H2SO4 = 0,14/0,9074 = 0,154M
Đề có thiếu khối lượng dung dịch H2SO4 không em nhỉ ?