cho 5,2g hỗn hợp bột Mg và Fe có tỷ lệ mol 2:1 hòa tan vừa hết vào 300ml dd HNO3 xM thì thu được 1,68l(đktc) hỗn hợp 2 khí N2O và NO có tỷ khối so với kk là 1,195 đồng thời thu được 1 dd chỉ có muối Mg(NO3)2 và Fe(NO3)3. tìm x
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

4 tháng 7 2017
Đáp án : D
nZn = 0,3 ; nMg = 0,6 mol
,nB = 0,2 mol ; MB = 33,5 => Do có H2 nên NO3 hết trước H+ ; muối trung hòa chỉ có anion SO42-
=> nN2O = 0,15 ; nH2 = 0,05 mol
Bảo toàn e : 2nZn + 2nMg = 8nN2O + 2nH2 + 8nNH4+
=> nNH4+ = 0,0625 mol
Bảo toàn N : nNaNO3 = nNH4 + 2nN2O = 0,3625 mol
Nếu nNaHSO4 = x mol
Sau phản ứng còn : (x + 0,3625 mol ) Na+ ; 0,3 mol Zn2+ ; 0,6 mol Mg2+ ; 0,0625 mol NH4+ ; x mol SO42-
Bảo toàn điện tích : x = 2,225 mol
=> m = 308,1375g

2 tháng 4 2018
Chọn đáp án A

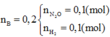

=0,05 mol
![]()

dung dịch A có

![]()
-> x=1,7(mol)
m=31,25+0,05.80+23.1,95+1,7.96=243,2
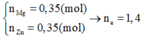
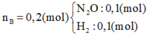

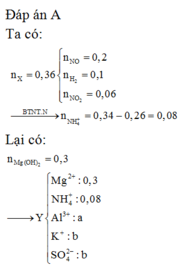

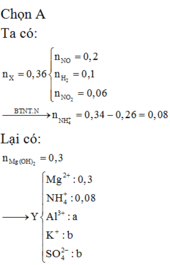

Gọi: nMg = 2x (mol) ⇒ nFe = x (mol)
⇒ 2x.24 + 56x = 5,2 ⇒ x = 0,05 (mol)
⇒ nMg = 0,1 (mol), nFe = 0,05 (mol)
BTNT Mg: nMg(NO3)2 = nMg = 0,1 (mol)
BTNT Fe: nFe(NO3)3 = nFe = 0,05 (mol)
Gọi: \(\left\{{}\begin{matrix}n_{N_2O}=a\left(mol\right)\\n_{NO}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow a+b=\dfrac{1,68}{22,4}=0,075\left(mol\right)\left(1\right)\)
Mà: Tỉ khối hhk so với kk là 1,195.
\(\Rightarrow44a+30b=1,195.29.0,075\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,025\left(mol\right)\\b=0,05\left(mol\right)\end{matrix}\right.\)
BTNT N, có: nHNO3 = 2nN2O + nNO + 2nMg(NO3)2 + 3nFe(NO3)3 = 0,45 (mol)
\(\Rightarrow x=C_{M_{HNO_3}}=\dfrac{0,45}{0,3}=1,5\left(M\right)\)