Cho 13.65g một kim loại chưa rõ hoá trị tác dụng với nước thu được một bazơ và 7.84 lít khí h2( đktc). Tìm CTHH của bazơ thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2M + H2O → 2MOH + H2
Mol: 0,1 0,1 0,05
\(M_M=\dfrac{3,9}{0,1}=39\left(g/mol\right)\)
⇒ M là kali (K)
b, \(m_{KOH}=0,1.56=5,6\left(g\right)\)

a,Gọi hóa trị của kim loại Alà x
2A + xH2SO4 => A2(SO4)x + xH2
nH2 = V/22.4 = 6,72/22.4 = 0.3 (mol)
Theo phương trình ,nA = 0.3.2/x = 0.6/x (mol)
M= m/n = 5,4/(0.6/x) = 9x
Nếu x = 1 => M = 9 (loại)
Nếu x = 2 => M = 18 (loại)
Nếu x = 3 => M = 27 (Al)

Bài 1 :
$n_{H_2} = 0,1(mol)$
Bảo toàn khối lượng :
$m_{H_2O} = 32 + 0,1.2 - 23,2 = 9(gam)$
$n_{H_2O} = 0,5(mol)$
X gồm $R$ và $R_2O$
$2R + 2H_2O \to 2ROH + H_2$
$R_2O + H_2O \to 2ROH$
Theo PTHH :
$n_R = 2n_{H_2} = 0,2(mol)$
$n_{H_2O} = n_R + n_{R_2O}$
$\Rightarrow n_{R_2O} = 0,3(mol)$
Ta có :
$0,2R + 0,3(2R + 16) = 23,2 \Rightarrow R = 23(Natri)$
Vậy X gồm $Na,Na_2O$
$n_{CO_2} = 0,2(mol) ; n_{NaOH} = \dfrac{6}{40} = 0,15(mol)$
Ta có :
$n_{NaOH} : n_{CO_2} = 0,15 : 0,2 = 0,75 < 1$.
Chứng tỏ sinh ra muối axit
$NaOH + CO_2 \to NaHCO_3$
$n_{NaHCO_3} = n_{NaOH} = 0,15(mol)$
$m_{muốI} = 0,15.84 = 12,6(gam)$
a, Gọi CTTQ của kim loại và oxit lần lượt là R và $R_2O$
Theo gt ta có: $n_{H_2}=0,1(mol)$
Bảo toàn e ta có: $n_{R}=0,2(mol)$
Bảo toàn khối lượng ta có: $n_{H_2O}=0,5(mol)$
$\Rightarrow n_{R_2O}=0,3(mol)$
Do đó ta có: \(0,2.R+0,3.\left(2R+16\right)=23,2\Rightarrow R=23\)
Vậy hỗn hợp X chứa Na và $Na_2O$
b, Ta có: $n_{NaOH}=0,15(mol);n_{CO_2}=0,2(mol)$
$NaOH+CO_2\rightarrow NaHCO_3$
Sau phản ứng dung dịch chứa 0,15 mol $NaHCO_3$
$\Rightarrow m_{muoi}=12,6(g)$

Câu 1:
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{HCl}=\dfrac{43,8}{36,5}=1,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{1,2}{2}\) \(\Rightarrow\) HCl còn dư, Fe p/ứ hết
\(\Rightarrow n_{H_2}=0,2\left(mol\right)\) \(\Rightarrow V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\)

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH : \(2X+O_2\underrightarrow{t^o}2XO\)
0,3 0,15 /mol
Ta có : \(0,3=\dfrac{19,2}{X}\Rightarrow X=64\) => X là Cu
\(m_{CuO}=80.0,3=24\left(g\right)\)
Gọi R là kim loại cần tìm.
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(2R+O_2\underrightarrow{t^o}2RO\)
\(\dfrac{19,2}{R}\) 0,15
\(\Rightarrow\dfrac{19,2}{R}=0,15\cdot2\Rightarrow R=64\Rightarrow Cu\)
Khối lượng oxit: \(m_{CuO}=0,3\cdot80=24g\)

\(R+2H_2O->R\left(OH\right)_2+H_2\\ n_R=n_{ROH}\\ \Rightarrow16,44:M_R=\dfrac{20,52}{M_R+17\cdot2}\\ M_R=137\left(Ba:barium\right)\)
\(n_R=\dfrac{16,44}{R}\left(mol\right);n_{R\left(OH\right)_2}=\dfrac{20,52}{R+\left(1+16\right).2}=\dfrac{20,52}{R+34}\left(mol\right)\\ R+H_2O\xrightarrow[]{}R\left(OH\right)_2+H_2\\ \Rightarrow n_R=n_{R\left(OH\right)_2}\\ \Leftrightarrow\dfrac{16,44}{R}=\dfrac{20,52}{R+34}\\ \Leftrightarrow16,44.\left(R+34\right)=R.20,52\\ \Leftrightarrow16,44R+558,96=20,52R \\ \Leftrightarrow558,96=20,52R-16,44R\\ \Leftrightarrow558,96=4,08R\\ \Leftrightarrow R=137\\\)
⇒R là Ba(Bari, 137)

\(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
BT e, có: nKL = 2nH2 = 0,07.2 = 0,14 (mol)
\(\Rightarrow M_{KL}=\dfrac{3,22}{0,14}=23\left(g/mol\right)\)
Vậy: KL cần tìm là Na.

Gọi kim loại cần tìm là `A` và có hóa trị là `x`
`2A + 2xH_2 O -> 2A(OH)_x + x H_2↑`
`[0,15] / x` `0,075` `(mol)`
`n_[H_2] = [ 1,68 ] / [ 22,4 ] = 0,075 (mol)`
`=>M_A = 3 / [ [ 0,15 ] / x ] = [ 3x ] / [ 0,15]`
`@ x = 1 => M_A = 20 ( g // mol ) ->` Loại
`@ x = 2 => M_A = 40 ( g // mol )->` Nhận và `A` là `Ca`
`@ x = 3 => M_A = 60 ( g // mol )->` Loại
Vậy tên kim loại cần tìm là `Ca`
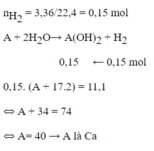
Gọi n là hóa trị của kim loại R cần tìm
$2R + 2nH_2O \to 2R(OH)_n + nH_2$
$n_{H_2} = \dfrac{7,84}{22,4} = 0,35(mol)$
Theo PTHH : $n_R = \dfrac{2}{n}.n_{H_2} = \dfrac{0,7}{n}(mol)$
$\Rightarrow \dfrac{0,7}{n}.R = 13,65$
$\Rightarrow R = 19,5n$
(Sai đề)