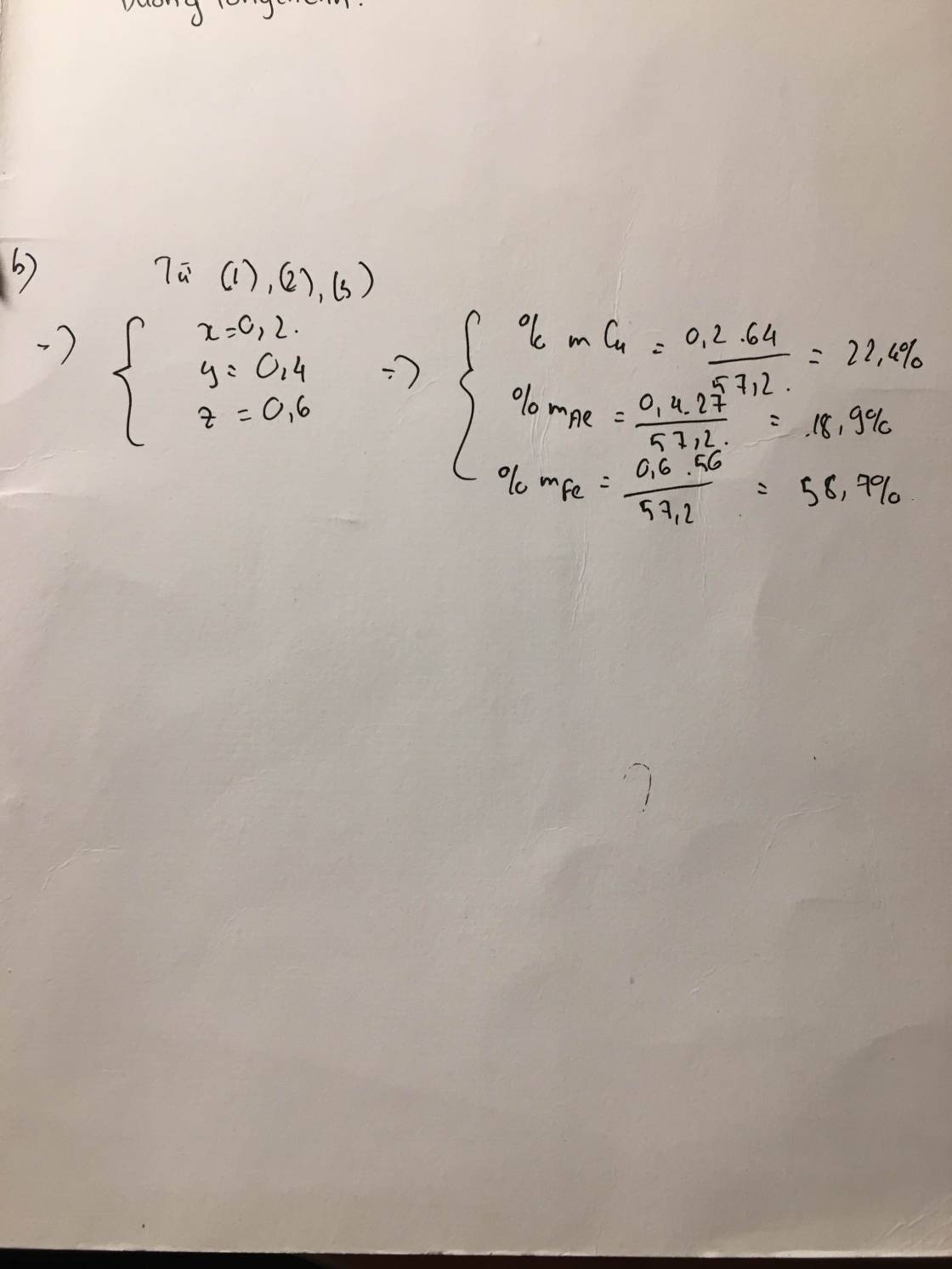hỗn hợp X gồm Cu,Al,Fe. cho 57,2g X t/d với dd HCl dư, sau phản ứng hoàn toàn thoát ra 26,88 lít H2(đktc). ở nhiệt độ cao 1,2 mol X t/d vừa đủ với 89,6 lít ko khí, trog đó 1/5 là khí oxi còn lại là khí nitơ (đktc)
a) viết phương trình hóa học của các p/ứ
b)tính % khối lượng của các chất trong X.
Cám ơn các bạn nhìu nha !!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Cu là x; Al là y và Fe là z
-> 64x+27y+56z=57,2
Cho 57,2 gam X tác dụng với HCl dư chỉ có Al và Fe phản ứng
Al + 3HCl -> AlCl3 +3/2 H2
Fe + 2HCl -> FeCl2 + H2
Ta có: nH2=26,88/22,4=1,2 mol =1,5y+z
1,2 mol X chứa k x mol Cu; ky mol Al và kz mol Fe
Cu + 1/2 O2 -> CuO
2Al +3/2 O2 -> Al2O3
2Fe + 3/2 O2 -> Fe2O3
Ta có: V O2=89,6.1/5=17,92 lít -> nO2=17,92/22,4=0,8 mol
-> nO2=0,5kx +0,75ky +0,75kz=0,8
-> (kx+ky+kz)/(0,5kx+0,75ky+0,75kz)=1,2/0,8=1,5
Giải được: x=317/730; y=242/365; z=15/73
-> mCu=27,79 gam; mAl=17,9 gam và mFe=11,51 gam

Đáp án C
BTKL => mAl = 23,3 – 15,2 = 8,1g => nAl = 0,3 mol và nCr2O3 = 0,1
2Al + Cr2O3 → Al2O3 + 2Cr
0,2 ← 0,1 → 0,2
Bảo toàn ne => 3nAl dư + 2nCr = 2nH2 => nH2 = 0,35 => V = 7,84



Bài hơi khó ạ , nếu không hiểu chỗ nào bạn cứ hỏi nha