ở 20C hòa tan 20,7g cuso4 vào 100g nước thì được một dung dịch cuso4 bão hòa.Vậy độ tan của CuSO4 trong nước ở 20C là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Độ tan : \(S = \dfrac{20,7}{100}.100 = 20,7(gam)\)
Công thức tính số tan : S = \(\dfrac{m_{chất\ tan}}{m_{dung\ môi}}\)

\(S_{CuSO_4\left(30^oC\right)}=\dfrac{75}{300}.100=25\left(g\right)\)

Giải thích các bước giải:
a Để tính nồng độ % của dung dịch CuSO4 bão hòa ở nhiệt độ trên, ta dùng công thức:
Nồng độ % = (Khối lượng chất tan/Công thức phân tử chất tan) / Thể tích dung dịch x 100%
Với dung dịch CuSO4 bão hòa ở 60 độ C, ta có:
Khối lượng chất tan (CuSO4) = 40 kg = 40000 g
Thể tích dung dịch = 100 ml = 100 cm^3
Công thức phân tử CuSO4: 1 Cu + 1 S + 4 O = 63.5 + 32 + 4 x 16 = 159.5
Nồng độ % = (40000/159.5) / 100 = 25.08 %
Vậy, nồng độ % của dung dịch CuSO4 bão hòa ở nhiệt độ 60 độ C là khoảng 25.08 %.
b) Để tính khối lượng H2O cần dùng để pha vào dung dịch trên và có được dung dịch CuSO4 10%, ta dùng công thức:
Khối lượng H2O = Khối lượng chất tan ban đầu - Khối lượng chất tan sau pha / (Nồng độ sau pha - Nồng độ ban đầu)
Giả sử khối lượng chất tan sau khi pha là x g (= 10/100 x khối lượng dung dịch sau khi pha)
Vậy, ta có:
Khối lượng chất tan sau pha = 32 g + x g
Nồng độ sau pha = 10%
Nồng độ ban đầu = 25.08 %
Ứng dụng công thức, ta có:
x = (32 - 0.1 x (32 + x)) / (0.100 - 0.2508)
10000 x = 32 - 0.1 x (32 + x)
10000 x = 32 - 3.2 - 0.1x^2
0.1x^2 - 9967.2x + 3.2 = 0
Giải phương trình trên bằng phương pháp giải phương trình bậc hai ta có:
x ≈ 0.3145 hoặc x ≈ 9965.88
Với x ≈ 0.3145, ta được khối lượng H2O ≈ 32 - 0.3145 = 31.6855 g
Vậy, để có được dung dịch CuSO4 10%, ta cần dùng khoảng 31.6855 g nước.

a)
Gọi khối lượng CuSO4 trong dd bão hòa ở 85oC là a (gam)
\(S_{85^oC}=\dfrac{a}{938,5-a}.100=87,7\left(g\right)\)
=> a = 438,5 (g)
=> mH2O(dd ở 85oC) = 938,5 - 438,5 = 500 (g)
\(n_{CuSO_4.5H_2O}=\dfrac{521,25}{250}=2,085\left(mol\right)\)
=> nCuSO4(tách ra) = 2,085 (mol)
\(m_{CuSO_4\left(dd.ở.25^oC\right)}=438,5-2,085.160=104,9\left(g\right)\)
mH2O(dd ở 25oC) = 500 - 50 - 2,085.5.18 = 262,35 (g)
\(S_{25^oC}=\dfrac{104,9}{262,35}.100=39,985\left(g\right)\)
b)
Gọi khối lượng CuSO4.5H2O là x (gam)
Gọi khối lượng nước cất cần lấy là y (gam)
\(n_{CuSO_4.5H_2O}=\dfrac{x}{250}\left(mol\right)\)
=> \(n_{CuSO_4}=\dfrac{x}{250}\left(mol\right)\)
=> \(m_{CuSO_4}=\dfrac{x}{250}.160=0,64x\left(g\right)\)
\(C\%=\dfrac{0,64x}{200}.100\%=20\%\)
=> x = 62,5 (g)
y = 200 - x = 137,5 (g)
Cách pha chế: Cân 62,5 gam CuSO4.5H2O, cho vào bình đựng. Cân 137,5 gam nước cất, rót từ từ vào bình đựng, khuấy đều thu được 200 gam dd CuSO4 20%

Gọi \(m_{CuSO_4\left(75^oC\right)}=a\left(g\right)\)
\(\rightarrow S_{CuSO_4\left(75^oC\right)}=\dfrac{a}{1654-a}.100=65,4\\ \Leftrightarrow a=654\left(g\right)\)
\(\rightarrow m_{H_2O}=1654-654=1000\left(g\right)\)
Giả sử mỗi ddbh có 100 g nước
\(\rightarrow m_{CuSO_4\left(\text{kết tinh}\right)}=65,4-10=55,4\left(g\right)\)
Mà thực tế có 1000 g nước
\(\rightarrow m_{CuSO_4\left(\text{kết tinh}\right)}=\dfrac{1000}{100}.55,4=554\left(g\right)\)
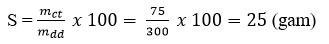

Độ tan của CuSO4 trong nước ở 20oC là :
S = \(\dfrac{20,7}{100}.100 = 20,7(gam)\)