Đốt cháy 6,5 g kẽm trong không khí a) tính thể tích không khí cần dùng ( đkc) b) để có được lượng oxy dùng cho phản ứng trên người ta phải điều chế bằng cách nung khối lượng gam thuốc tím . Tính khối lượng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
0,3--->0,2----->0,1
\(\Rightarrow m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
b) \(V_{O_2}=0,2.22,4=4,48\left(l\right)\Rightarrow V_{kk}=4,48.5=22,4\left(l\right)\)
c) \(n_{O_2\left(hao,h\text{ụt}\right)}=0,2.10\%=0,02\left(mol\right)\)
\(\Rightarrow n_{O_2\left(t\text{ổng}\right)}=0,2+0,02=0,22\left(mol\right)\)
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
0,44<------------------------------------0,22
\(\Rightarrow m_{KMnO_4}=0,44.158=69,52\left(g\right)\)

a.\(n_{Al_2O_3}=\dfrac{30,6}{102}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,6 0,45 0,3 ( mol )
\(m_{Al}=0,6.27=16,2g\)
\(V_{O_2}=0,45.22,4=10,08l\)
\(V_{kk}=10,08.5=50,4l\)
b.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(m_{KClO_3}=0,3.122,5=36,75g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(n_{KClO_3}=\dfrac{0,3}{75\%}=0,4mol\)
\(m_{KClO_3}=0,4.122,5=49g\)

2KMnO4 --to--> MnO2 + O2 + K2MnO4
0,6 <------------------------- 0,3 (mol)
a) nO2 = V/22,4 = 6,12/22,4 ≃ 0,3 (mol)
=> mKMnO4 = n . M = 0,6 . 158 = 94,8 ( g)
b) *PT (a) thu được khí O2
3O2 + 4Al --to--> 2Al2O3
0,3 -> 0,4 (mol)
mO2 = 0,3 . 32 = 9,6 (g)
mAl = 0,4 . 27 = 10,8 (g)
Khối lượng chất rắn cần tìm:
mAl2O3 = mO2 + mAl = 9,6 + 10,8 = 20,4 (g)

a.\(n_{C_4H_{10}}=\dfrac{4,48}{22,4}=0,2mol\)
\(2C_4H_{10}+13O_2\rightarrow\left(t^o\right)8CO_2+10H_2O\)
0,2 1,3 ( mol )
\(V_{O_2}=1,3.22,4=29,12l\)
\(V_{kk}=29,12.5=145,6l\)
b.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
2,6 1,3 ( mol )
\(m_{KMnO_4}=2,6.158=410,8g\)
\(n_{C_4H_{10}}=\dfrac{4,48}{22,4}=0,2\left(MOL\right)\\
pthh:2C_2H_{10}+13O_2\underrightarrow{t^o}8CO_2+10H_2O\)
0,2 1,3
=> \(V_{O_2}=1,3.22,4=29,12\left(l\right)\\
V_{kk}=29,12:20\%=145,6\left(l\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
2,6 1,3
=> \(m_{KMnO_4}=2,6.158=410,8\left(g\right)\)

\(n_{H_2}=\dfrac{6,1975}{22,4}=0,29mol\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,29 0,145
b)\(V_{O_2}=0,145\cdot22,4=3,248l\)
\(\Rightarrow V_{kk}=5V_{O_2}=5\cdot3,248=16,24l\)
c)\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,29 0,145
\(m_{KMnO_4}=0,29\cdot158=45,82g\)
TK
nH2=5,6/22,4=0,25(mol)
2H2+O2--->2H2O
0,25__0,125
VO2=0,125.22,4=2,8(l)
=>Vkk=2,8.5=14(l)
2KMnO4--->K2MnO4+MnO2+O2
0,25________________________0,125
mKMnO4=0,25.158=39,5(g)

Bài 4. 2\(KMnO_4\) ---> \(K_2MnO_4\) + \(MnO_2\) + \(O_2\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,3 mol 0,3 mol
a. + Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
+ Khối lượng của \(KMnO_4\) (thuốc tím) cần dùng:
\(m_{KMnO_4}\) = n . M = 0,6 . 158 = 94,8 (g)
b. 2\(KClO_3\) ---> 2\(KCl\) + 3\(O_2\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,3 mol
Số g \(KClO_3\) dùng để điều chế:
\(m_{KClO_3}\) = n . M = 0,2 . 122,5 = 24,5 (g)
c. 2Cu + \(O_2\) ---> 2\(CuO\) (Lập và cân bằng phương trình)
0,6 mol 0,3 mol 0,6 mol
Số g của CuO sau phản ứng thu được:
\(m_{CuO}\) = n . M = 0,6 . 80 = 48 (g)
________________________________________
Bài 4 trước nha bạn, có gì sai thì nhắn mình :))
Bài 5. CuO + \(H_2\) ---> Cu + \(H_2O\) (Lập và cân bằng phương trình)
0,2 mol 0,2 mol 0,2 mol 0,2 mol
a. + Số mol của CuO:
\(n_{CuO}\) = \(\dfrac{m}{M}\) = \(\dfrac{16}{80}\) = 0,2 (mol)
+ Thể tích của \(H_2\)
\(V_{H_2}\) = n . 22,4 = 0,2 . 22,4 = 4,48 (lít)
b. Khối lượng Cu sau phản ứng:
\(m_{Cu}\) = n . M = 0,2 . 64 = 12,8 (g)
______________________________
Bài 5 nha, sai thì nhắn mình :))

a) \(n_{Fe}=\dfrac{33,6}{56}=0,6\left(mol\right)\)
PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
0,6--->0,4------->0,2 (mol)
=> \(m_{Fe_3O_4}=0,2.232=46,4\left(g\right)\)
b) \(V_{O_2\left(\text{đ}kc\right)}=0,4.24,79=9,916\left(l\right)\)
c) PTHH: \(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\)
\(\dfrac{4}{15}\)<-------------------0,4 (mol)
=> \(m_{KClO_3}=\dfrac{4}{15}.122,5=\dfrac{98}{3}\left(g\right)\)
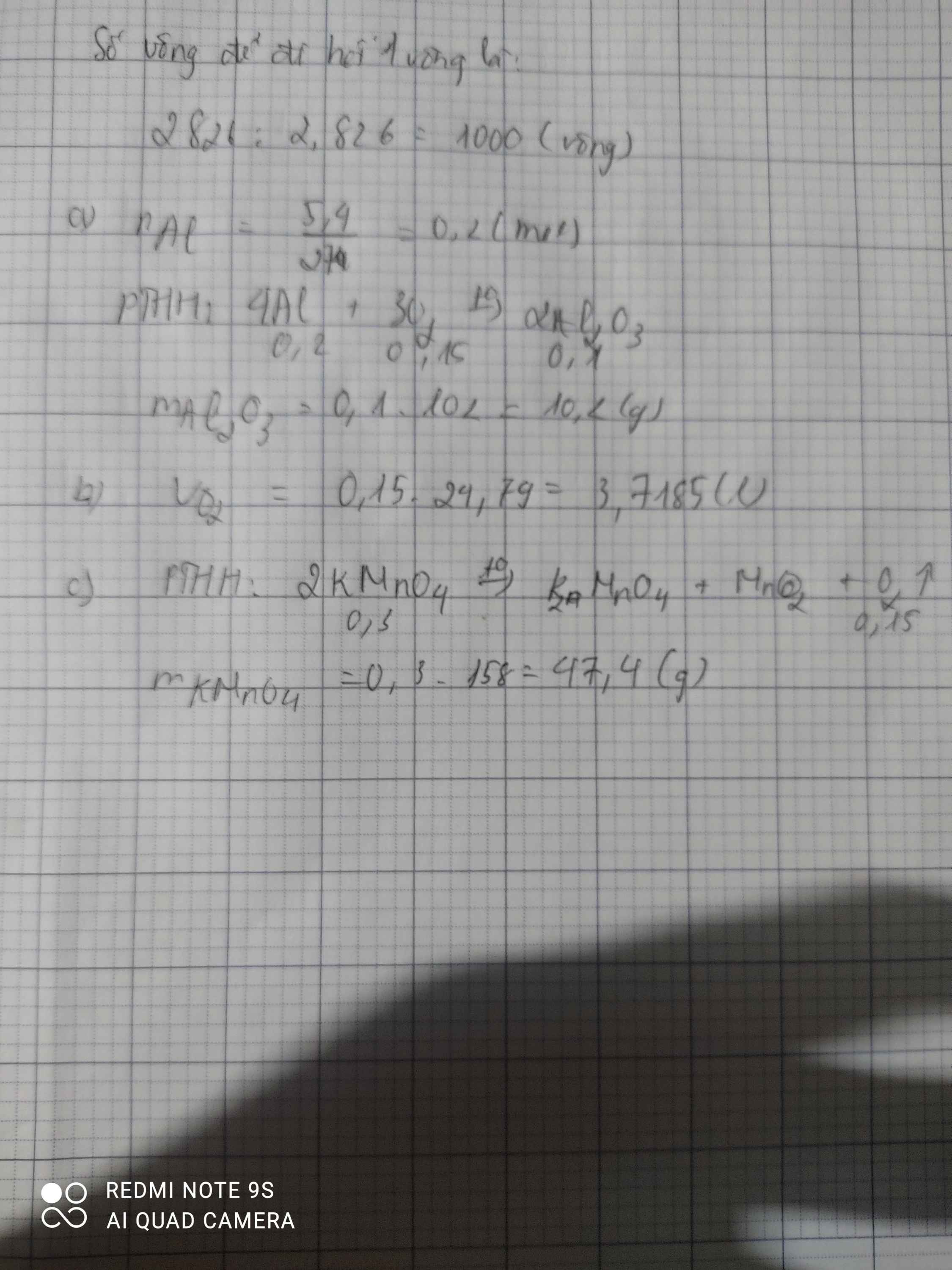
\(n_{Zn}=\dfrac{m}{M}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ PTHH:2Zn+O_2-^{t^o}>2ZnO\)
tỉ lệ: 2 : 1 : 2
n(mol) 0,1---->0,05--->0,1
\(V_{O_2\left(dktc\right)}=n\cdot22,4=0,05\cdot22,4=1,12\left(l\right)\\ PTHH:2KMnO_4-^{t^o}>K_2MnO_4+MnO_2+O_2\)
tỉ lệ 2 : 1 : 1 : 1
n(mol) 0,1<----------------------------------------0,05
\(m_{KMnO_4}=n\cdot M=0,1\cdot\left(39+55+16\cdot4\right)=15,8\left(g\right)\)