Hòa tan 4,8 gam kim loại X trong dung dịch HCl dư thu được 4,48 lít H2(đktc). Xác định kim loại X?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: \(2M+2xHCl\rightarrow2MCl_x+xH_2\uparrow\) (x là hóa trị của M)
Tính theo sản phẩm
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(\Rightarrow n_M=\dfrac{0,4}{x}\left(mol\right)\) \(\Rightarrow M=\dfrac{4,8}{\dfrac{0,4}{x}}=12x\)
Ta thấy với \(x=2\) thì \(M=24\) (Magie)
Mặt khác: \(n_{HCl}=\dfrac{50\cdot36,5\%}{36,5}=0,5\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{MgCl_2}=n_{H_2}=0,2\left(mol\right)\\n_{HCl\left(dư\right)}=0,1\left(mol\right)\end{matrix}\right.\)
Ta lại có: \(m_{dd\left(sau.p/ứ\right)}=m_{Mg}+m_{ddHCl}-m_{H_2}=4,8+50-0,2\cdot2=54,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,2\cdot95}{54,4}\cdot100\%\approx34,93\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,1\cdot36,5}{54,4}\cdot100\%\approx6,71\%\end{matrix}\right.\)

Đáp án A
Oxit chưa biết của kim loại nào → Gọi MxOy
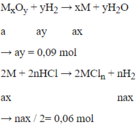
Mà : 56ax + 16ay = 4,8
→ ax = 0,06
→ x : y = ax : ay = 0,06 : 0,09 = 2 : 3 => M2O3
→ n = 0,12 : 0,06 = 2 => M hóa trị II
→ Chỉ có Fe thỏa mãn vì nó có hai hóa trị
Lưu ý: Bài toán này dễ nhầm lẫn nếu không để ý sự thay đổi hóa trị ở 2 phương trình.

Theo bài ra: nH2 = 1,12/22,4 = 0,05 mol
nHCl < 0,5 x 1 = 0,5 mol
Các phương trình pứ xảy ra:
Fe + 2HCl ===> FeCl2 + H2
N + 2HCl ===> NCl2 + H2 ( đặt công thức chung của hỗn hợp là N)
0,05 0,05 ( giả thiết nhé bạn )
=> MN= 2 / 0,05 = 40 gam
Vì MFe = 56 > 40 => MM < 40 (1)
Mặt khác , ta có: MM > 4,8 / 0,5 = 9,6 (2)
Từ (1), (2), ta có 9,6 < MM < 40 và M hóa trị II
=> M là Magie

Đáp án C
Gọi kim loại là R.
![]() = 0,2 (mol)
= 0,2 (mol)
R + 2HCl → RCl2 + H2
0,2 ← 0,2 (mol)
![]() = 24(Mg)
= 24(Mg)

Giả sử KL có hóa trị n.
PT: \(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{n}nH_2=\dfrac{0,4}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{4,8}{\dfrac{0,4}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MM = 24 (g/mol) là tm
Vậy: M là Mg.
Ta có: \(n_{MgCl_2}=n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgCl_2}=0,2.95=19\left(g\right)\)

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2A + 3H2SO4 --> A2(SO4)3 + 3H2
_____0,2<---------------------------------0,3______(mol)
=> \(M_A=\dfrac{5,4}{0,2}=27\left(g/mol\right)=>Al\)
Giả sử X có hóa trị n.
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2X+2nHCl\rightarrow2XCl_n+nH_2\)
Theo PT: \(n_X=\dfrac{2}{n}n_{H_2}=\dfrac{0,4}{n}\left(mol\right)\)
\(\Rightarrow M_X=\dfrac{4,8}{\dfrac{0,4}{n}}=12n\left(g/mol\right)\)
Với n = 2 thì MX = 24 (g/mol)
Vậy: X là Mg.