Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây:
a) Thay a g Zn hạt bằng a g bột Zn
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.


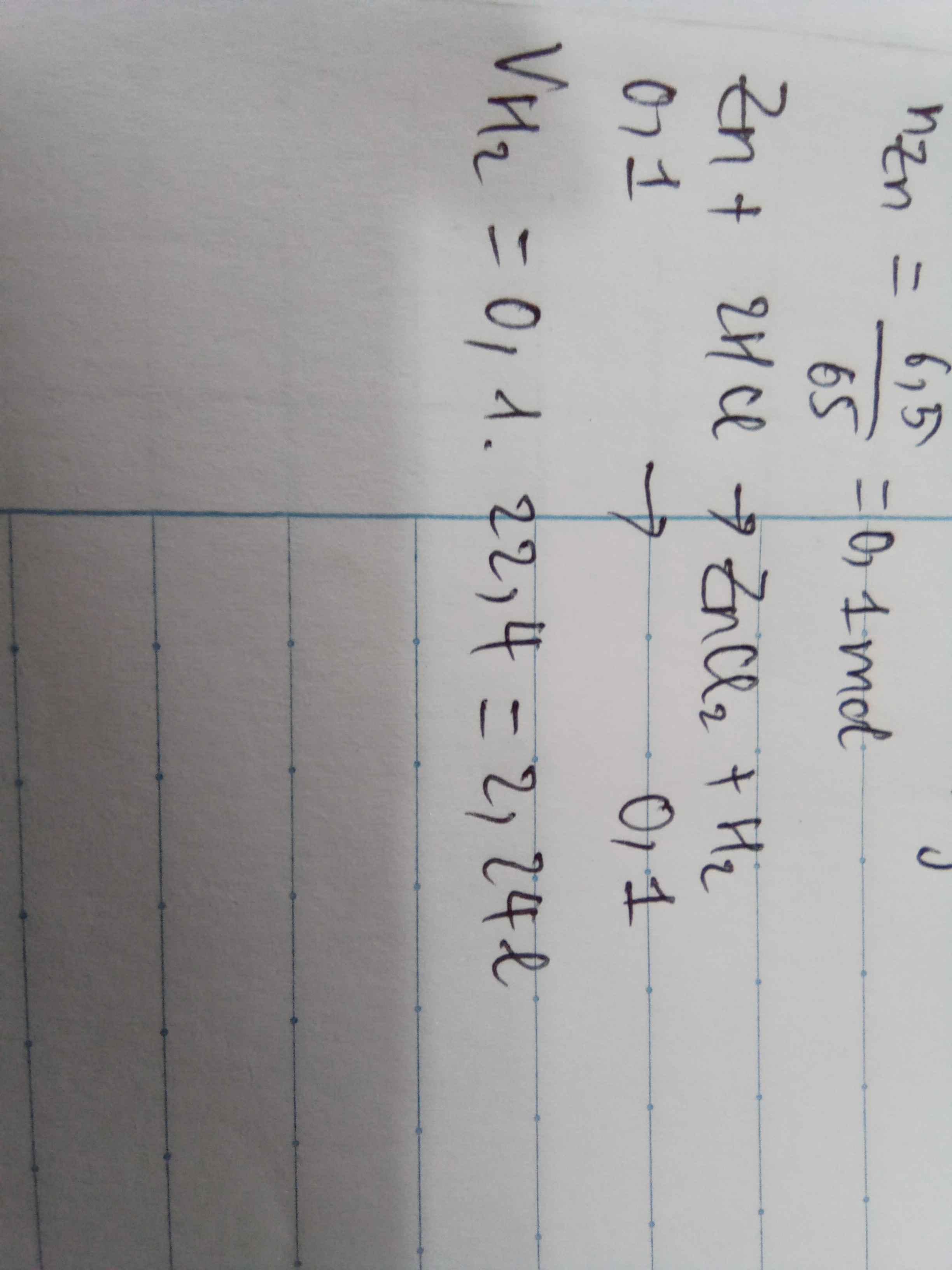

a) Khi thay a g hạt Zn = a g bột Zn
=> Chất tham gia được nghiền nhỏ
=> Diện tích bề mặt tiếp xúc của Zn với HCl tăng
=> Tốc độ phản ứng tăng
=> Khí thoát ra nhanh hơn
b) Khi thay dung dịch HCl 2 M = dung dịch HCl 1 M
=> Nồng độ chất tham gia giảm
=> Tốc độ phản ứng giảm
=> Khí thoát ra chậm hơn
c) Khi đun nóng nhẹ dung dịch HCl
=> Nhiệt độ của phản ứng tăng
=> Tốc độ phản ứng tăng
=> Khí thoát ra nhanh hơn