cho mẫu Na vào nước. có 2.24 lít khí H2 bay lên, tính khối lượng Na
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Na + 2H2O \(\rightarrow\) 2NaOH + H2
\(nH_2=\dfrac{4,48}{22,4}=0,2mol\)
Theo pt: nNa = 2nH2 = 0,4 mol
=> mNa = 0,4 . 23 = 9,2g
PT:\(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có:\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT:\(n_{Na}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{Na}=0,4.23=9,2\left(g\right)\)

PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Na}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow m_{Na}=0,4.23=9,2\left(g\right)\)
Bạn tham khảo nhé!

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư
⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2)
⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

\(m_{NaOH}=200.10\%=20\left(g\right)\Rightarrow n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: 0,5 0,5 0,5
\(m_{Na}=0,5.23=11,5\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)

\(a.2Na+2H_2O\rightarrow2NaOH+H_2\\ b.n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\\ n_{H_2}=\dfrac{1}{2}n_{Na}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\\ n_{NaOH}=n_{Na}=0,4\left(mol\right)\\ \Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\\ c.H_2+CuO-^{t^o}\rightarrow Cu+H_2O\\ n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\\ LTL:\dfrac{0,2}{1}>\dfrac{0,15}{1}\Rightarrow H_2dưsauphảnứng\\ n_{H_2\left(pứ\right)}=n_{CuO}=0,15\left(mol\right)\\ \Rightarrow n_{H_2\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\\ \Rightarrow m_{H_2\left(Dư\right)}=0,05.2=0,1\left(g\right)\)
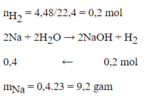
nH2 = 2.24/22.4 = 0.1 (mol)
2Na + 2H2O => 2NaOH + H2
0.2.........................................0.1
mNa = 0.2 * 23 = 4.6 (g)
n\(_{H_2}\)= \(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
2 Na + 2 H\(_2O\) → 2 NaOH + H\(_2\)
0,2 mol ← 0,1 mol
m\(_{Na}=m.n=0,2.23=4,6\left(g\right)\)
Vậy mẫu Na có khối lượng 4,6 g