Đốt hoàn toàn hỗn hợp Mg và Fe trong oxi dư, sau phản ứng thấy khối lượng chất rắn nặng gấp 1,5 lần khối lượng chất rắn ban đầu. %m Mg trong hỗn hợp đầu là :
A. 30% B. 40% C. 60% D. 70%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo đề: \(m_{hh}=36\left(g\right)\)
\(\Rightarrow m_{Mg}+m_{Fe}=36\\ \Rightarrow24x+56y=36\left(1\right)\)
\(PTHH:2Mg+O_2\underrightarrow{t^o}2MgO\\ \left(mol\right)....x\rightarrow...0,5x.....x\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ \left(mol\right)....y\rightarrow...\dfrac{2}{3}y....\dfrac{1}{3}y\)
Theo đề: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(\Rightarrow0,5x+\dfrac{2}{3}y=0,6\left(2\right)\)
\(\xrightarrow[\left(2\right)]{\left(1\right)}\left\{{}\begin{matrix}24x+56y=36\\0,5x+\dfrac{2}{3}y=0,6\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,8\\y=0,3\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,8.24=19,2\left(g\right)\\m_{Fe}=0,3.56=16,8\left(g\right)\end{matrix}\right.\\ m_r=m_{MgO}+m_{Fe_3O_4}=0,8.40+\dfrac{1}{3}.0,3.232=55,2\left(g\right)\)
PTHH: C+O2→CO20,3mol:0,3mol→0,3molC+O2→CO20,3mol:0,3mol→0,3mol
S+O2→SO20,2mol:0,2mol→0,2molS+O2→SO20,2mol:0,2mol→0,2mol
mC=36%10100%=3,6(g)⇔nC=3,612=0,3(mol)mC=36%10100%=3,6(g)⇔nC=3,612=0,3(mol)
mS=10−3,6=6,4(g)⇔nS=6,432=0,2(mol)mS=10−3,6=6,4(g)⇔nS=6,432=0,2(mol)
VO2=(0,3+0,2)22,4=11,2(l)VO2=(0,3+0,2)22,4=11,2(l)
mhh=mCO2+mSO2=0,3.44+0,2.64=26(g)

Gọi nMg = nAl = a (mol)
=> 24a + 27a = m
=> 51a = m
PTHH: 2Mg + O2 --to--> 2MgO
a---------------->a
4Al + 3O2 --to--> 2Al2O3
a------------------>0,5a
=> 40a + 51a = m + 2
=> 91a = 51a + 2
=> a = 0,05 (mol)
m = 0,05.24 + 0,05.27 = 2,55 (g)
Các PTHH của phản ứng:
2Mg+O2-->(to) MgO(1)
2mol 1mol 1mol
x mol 0,5mol
4Al+3O2-->(to) 2Al2O3 (2)
4mol 3mol 2mol
xmol 3/4mol
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ mO2 = 2g.
nO2=2/32=0,625(mol)
Vì Mg và Al có số mol bằng nhau. Gọi nMg=nAl = x mol
Từ phương trình (1) và (2) ta có: nO2=0,5x+3/4x=0,625(mol)
=> x= 0,05(mol)
mhh=0,05(27+24) =2,55(g)

Ta có :
$m_{O_2\ pư} = m_{tăng} = 4(gam) \Rightarrow n_{O_2} = \dfrac{4}{32} = 0,125(mol)$
Gọi $n_{Mg} = n_{Al} = a(mol)$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
Theo PTHH : $n_{O_2} = 0,5a + 0,75a = 0,125 \Rightarrow a = 0,1(mol)$
$\Rightarrow m = 0,1.24 + 0,1.27 = 5,1(gam)$

Các PTHH của phản ứng:
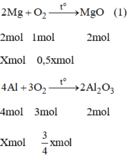
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ m O 2 = 2g.
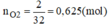
Vì Mg và Al có số mol bằng nhau. Gọi n M g = n A l = x mol
Từ phương trình (1) và (2) ta có:
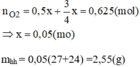

a) Theo đề bài: \(m_{Cu}=0,3\left(g\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
a______2a______a_____a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b_____2b______b____b (mol)
Ta lập được hệ phươn trình: \(\left\{{}\begin{matrix}24a+56b=18,7-0,3=18,4\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3\cdot24=7,2\left(g\right)\\m_{Fe}=0,2\cdot56=11,2\left(g\right)\end{matrix}\right.\)
b) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
Ta có: \(n_{Cu}=\dfrac{0,3}{64}=\dfrac{3}{640}\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=\dfrac{3}{640}\cdot22,4=0,105\left(l\right)\)
a)
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(mol)$
$m_X = 24a + 56b = 0,3 = 18,7(gam)$
Suy ra a = 0,3 ; b = 0,2
$m_{Mg} = 0,3.24 = 7,2(gam)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
b)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$n_{SO_2} = n_{Cu} = \dfrac{0,3}{64}$
$V = \dfrac{0,3}{64}.22,4 = 0,105(lít)$

Đặt \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo đề: \(m_{hh}=39\left(g\right)\)
\(\Rightarrow m_{Al}+m_{Fe}=39\\ \Rightarrow27x+56y=39\left(1\right)\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\ \left(mol\right)....x\rightarrow..0.75x....0,5x\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ \left(mol\right)....y\rightarrow..\dfrac{2}{3}y.....\dfrac{1}{3}y\)
Theo đề: \(n_{O_2}=\dfrac{V}{22,4}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
\(\Rightarrow0,75x+\dfrac{2}{3}y=0,55\left(2\right)\)
\(\xrightarrow[\left(1\right)]{\left(2\right)}\left\{{}\begin{matrix}27x+56y=39\\0,75x+\dfrac{2}{3}y=0,55\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,6\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,6.56=33,6\left(g\right)\end{matrix}\right.\\ m_r=m_{Al_2O_3}+m_{Fe_3O_4}=0,5.0,2.102+\dfrac{1}{3}.0,6.232=56,6\left(g\right)\)

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

FeO + CO -> Fe + CO2
mol: x -> x
pt2: Fe2O3 + CO ->2 Fe + CO2
mol: y -> 2y
theo gt thu được 2.94 g
Fe trong đó có Fe tạo thành và Fe ban đầu và gọi Z là số mol Fe ban đầu
=> ta có Pt : 72x + 160y +56z=3.54 (1)
và x + 2y + z =3.92/56=0.0525 (2)
hh trên vào CuSO4 thì chỉ có Fe phản ứng
pt: Fe + CuSO4 -> FeSO4 + Cu
mol: z -> z
thu được 3.72g rắn gồm Cu , FeO, Fe2O3
=> ta có pt: 72x + 160y + 64Z=3.72 (3)
từ (1),(2),(3) ta có x=0.015= nFeO , y=0.0075 mol =nFe2O3 , z=0.0225 mol=nFe
Có số mol áp dụng công thức m=n*M em tự tính khối lượng các chất nha
Số ko đẹp lắm nên số mol hơi dài,cứ giữ nguyên để tính để tránh sai số
CHÚC EM HỌC TỐT !!!!!!(nhớ hậu tạ nha hi hi.....)
PTHH: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
\(4Fe+3O_2\underrightarrow{t^o}2Fe_2O_3\)
Giả sử hỗn hợp ban đầu có khối lượng 100 (g)
Gọi số mol Mg, Fe là a, b (mol)
=> 24a + 56b = 100 (1)
Theo PTHH: \(\left\{{}\begin{matrix}n_{MgO}=a\left(mol\right)\\n_{Fe_2O_3}=0,5b\left(mol\right)\end{matrix}\right.\)
mchất rắn sau pư = 40a + 160.0,5b = 100.1,5
=> 40a + 80b = 150 (2)
(1)(2) => a = 1,25 (mol); b = 1,25 (mol)
=> \(\%m_{Mg}=\dfrac{1,25.24}{100}.100\%=30\%\)